题目内容
把Fe粉、Cu粉置于FeCl3溶液中,充分反应后加入KSCN不现红色,下列情况不能成立的是
- A.铁不剩余,Cu剩余
- B.铁、铜均剩余
- C.铁剩余,含Cu2+
- D.铜剩余,含Fe2+
分析:A、铜剩余,铜能够和三价铁离子反应,溶液中不会存在Fe3+;
B、铁、铜均剩余,溶液中不会存在Fe3+;
C、铁剩余,溶液中不会存在Cu2+;
D、铜剩余,溶液中存在含Fe2+.
解答:充分反应后加入KSCN不现红色,证明溶液中没有Fe3+;
A、还原性铁大于铜,铜有剩余,溶液中不会存在Fe3+,故A不选;
B、铁过量,会出现铁、铜均剩余,溶液中不存在 Fe3+,故B不选;
C、若是铁剩余,溶液中一定不含Cu2+,不能成立,故C选;
D、铜有剩余,不会存在Fe3+,但是溶液中一定有Fe2+,故D不选;
故选C.
点评:本题考查了三价铁离子的检验方法,难度中等.

I.类比法是化学学习中常用的方法,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是 Fe(NO3)2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生称FeCl3,当铁粉过量时产物是FeCl2,为了验证该观点是否正确,该同学将一定量的铁粉与Cl2恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下:
⑴提出假设:
假设1:该固体物质是FeCl2
假设2:该固体物质是FeCl3
假设3:该固体物质是
⑵设计实验方案:
取少量固体物质置于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如下表:
实验方法 | 实验现象 | 结论 |
在溶液中加KSCN溶液 |
| 固体物质中有FeCl3 |
在KMnO4溶液中加少量A 溶液 | KmnO4溶液颜色无明显变化 | 固体物质中不含 |
Ⅱ.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得FeCl3溶液,设计了下列实验步骤:
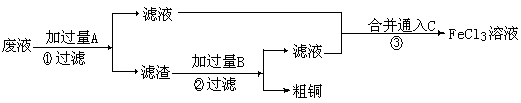
⑶①写出一个能证明还原性Fe比Cu强的离子方程式: ,该反应在上图步骤 中发生。
②甲、乙、丙、丁四位同学利用上述反应原理,分别设计的原电池如下图所示:
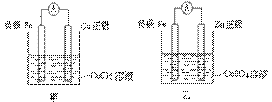
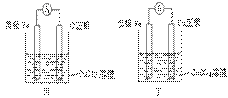
四位同学的设计的原电池装置图,符合上述反应原理的是 。
③请写出正、负极的电解反应式:
正极: 、负极: (电极反应式)。
⑷上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及电极反应式