题目内容
7.(1)标准状况下,1.204×1023个CO2分子和3.36L CO气体的物质的量之比为4:3,质量之比为44:21,体积之比为4:3,氧原子数之比为8:3,分子数之比为4:3,原子数之比为2:1.(2)已知20g Na0H的物质的量为0.5mol,则Na0H的摩尔质量为40g/mol,含氧原子数目为0.5NA个.
分析 (1)依据n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$=$\frac{V}{Vm}$结合二氧化碳、一氧化碳组成:二氧化碳含有2个O,1个C;一氧化碳含有1个O,1个C;
(2)依据m=nM计算氢氧化钠摩尔质量,结合1mol氢氧化钠含有1mol氧原子解答.
解答 解:(1)标准状况下,1.204×1023个CO2分子物质的量$\frac{1.204×1{0}^{23}}{6.02×1{0}^{23}}$=0.2mol,质量为0.2mol×44g/mol=8.8g,含有氧原子物质的量为0.2mol×2=0.4mol;含有原子数为0.2mol×3=0.6mol;
3.36L CO气体的物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,质量为0.15mol×28g/mol=4.2g;含有氧原子物质的量为0.15mol×1=0.15mol;含有原子数为0.15mol×2=0.3mol;
所以:气体的物质的量之比为4:3,质量之比为44:21,体积之比为4:3,氧原子数之比为8:3,分子数之比为4:3,原子数之比为2:1;
故答案为:4:3;44:21;4:3;8:3;4:3;2:1;
(2)氢氧化钠摩尔质量M=$\frac{20g}{0.5mol}$=40g/mol,含氧原子数目个数为:0.5mol×1×NA=0.5NA;
故答案为:40g/mol;0.5NA.
点评 本题考查了物质的量有关计算,明确以物质的量为核心的计算公式是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.有下列六种转化途径,某些反应条件和产物已省略,下列有关说法正确的是( )
途径①Fe$\stackrel{稀HCl}{→}$FeCl2溶液
途径②Fe $\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{Fe、水}{→}$FeCl2溶液
途径③Cl2$\stackrel{Na_{2}SO_{3}溶液}{→}$Na2SO4溶液
途径④Cl2$\stackrel{NaOH溶液}{→}$NaClO溶液$\stackrel{Na_{2}SO_{3}溶液}{→}$Na2SO4 溶液
途径⑤S$\stackrel{浓HNO_{3}}{→}$H2SO4
途径⑥S$\stackrel{O_{2}}{→}$SO2$\stackrel{O_{2}}{→}$SO3 $\stackrel{H_{2}O}{→}$H2SO4.
途径①Fe$\stackrel{稀HCl}{→}$FeCl2溶液
途径②Fe $\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{Fe、水}{→}$FeCl2溶液
途径③Cl2$\stackrel{Na_{2}SO_{3}溶液}{→}$Na2SO4溶液
途径④Cl2$\stackrel{NaOH溶液}{→}$NaClO溶液$\stackrel{Na_{2}SO_{3}溶液}{→}$Na2SO4 溶液
途径⑤S$\stackrel{浓HNO_{3}}{→}$H2SO4
途径⑥S$\stackrel{O_{2}}{→}$SO2$\stackrel{O_{2}}{→}$SO3 $\stackrel{H_{2}O}{→}$H2SO4.
| A. | 由途径①和②分别制取1molFeCl2,理论上各消耗1molFe,各转移2mole- | |
| B. | 由途径③和④分别制取1 mol Na2SO4,理论上各消耗1 mol Cl2,各转移2mol e- | |
| C. | 由途径⑤和⑥分别制取1 mol H2SO4,理论上各消耗1mol S,各转移6mol e- | |
| D. | 以上说法都不正确 |
2.下列做法能体现理性、低碳、环保生活理念的是( )
| A. | 要求处理垃圾,但是又极力反对建造垃圾焚烧处理厂行为 | |
| B. | 夏天盖着被子吹空调 | |
| C. | 尽量购买本地的、当季的食物,减少食物的加工过程 | |
| D. | 开着5.6L排量的汽车直播声讨北京的雾霾天气 |
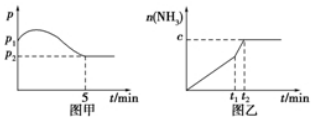
12. 甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2 $?_{高温高压}^{催化剂}$ CH3OH,工艺中一些参数如图;目前正在开发的新法2CH4+O2$?_{高温高压}^{催化剂}$2CH3OH,下列有关新法和旧法的说法正确的是( )
甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2 $?_{高温高压}^{催化剂}$ CH3OH,工艺中一些参数如图;目前正在开发的新法2CH4+O2$?_{高温高压}^{催化剂}$2CH3OH,下列有关新法和旧法的说法正确的是( )
 甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2 $?_{高温高压}^{催化剂}$ CH3OH,工艺中一些参数如图;目前正在开发的新法2CH4+O2$?_{高温高压}^{催化剂}$2CH3OH,下列有关新法和旧法的说法正确的是( )
甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2 $?_{高温高压}^{催化剂}$ CH3OH,工艺中一些参数如图;目前正在开发的新法2CH4+O2$?_{高温高压}^{催化剂}$2CH3OH,下列有关新法和旧法的说法正确的是( )| A. | 旧法生产中,由图知CO与H2合成甲醇的反应属于放热反应 | |
| B. | 旧法生产中,选择合适的催化剂时,可推测高压法合成比低压法合成更有发展优势 | |
| C. | 新法与旧法相比,反应更困难 | |
| D. | 新法生产中,需控制V(CH4)/V(O2)=9:1,目的是提高空气中氧气的转化率 |
19.关于一氧化碳和氢气,下列叙述不正确的是( )
| A. | 都具有可燃性 | |
| B. | 通常状况下都是没有颜色、没有气味的气体 | |
| C. | 都具有还原性 | |
| D. | 都有剧毒 |
17.下列化学药品与其危险化学品图形标志不一致的一组是( )
| A. |  烧碱 烧碱 | B. |  甲烷 | C. |  酒精 | D. |  镁条 |