题目内容
在两个烧杯中分别盛有100mL 3.0mol·L-1的盐酸和氢氧化钠溶液,向两个烧杯中分别加入等质量的铝粉,在相同状况下生成的气体的体积比为2∶5,则加入的铝粉的质量为 [ ]
| A.8.1g | B.6.75g | C.5.4g | D.2.7g |
B
试题分析:根据反应的离子方程式:2Al+6H+=2Al3++3H2↑ 2Al+2OH-+2H2O=2AlO2-+3H2↑,若铝均不足,则生成氢气的体积比为1∶1;若铝均过量,则生成氢气的体积比为1∶3。根据生成氢气的体积比为2∶5,则说明铝和盐酸的反应中铝是过量的,而铝和烧碱溶液的反应中,铝是不足量的。根据HCl的量可求出生成H2 0.15mol,则与NaOH反应生成的H2为0.375mol,所以反应的铝为0.25mol,质量为6.75g。答案选B。
点评:本题难度较大,主要要分析出相同量的铝与相同物质的量的盐酸和NaOH反应,谁过量谁不足。

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
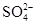 的物质的量浓度是 。
的物质的量浓度是 。