题目内容
4.下列关于说法中正确的是( )| A. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+566.0 kJ | |
| B. | H2SO4和NaOH反应的中和热△H=-57.3 kJ•mol-1,则1molH2SO4和1molBa(OH)2反应的反应热△H=-114.6kJ•mol-1 | |
| C. | 石墨转化为金刚石是吸热反应,可知金刚石的燃烧热更大 | |
| D. | 在恒温时,压缩容器的体积,则2SO2+O2?2SO3平衡正向移动,该反应的△H减小 |
分析 A、燃烧热是完全燃烧1mol物质生成最稳定的产物所放出的热量;
B、中和热是强酸强碱稀溶液生成1mol水放出的热量,氢氧化钡和硫酸中和反应生成水和沉淀,沉淀过程含有沉淀热;
C、能量越高越不稳定,石墨转化为金刚石是吸热反应,所以金刚石能量高;
D、对于反应2SO2+O2?2SO3,增大压强平衡正向移动,但反应热不变.
解答 解:A、根据燃烧热的概念,CO的标准燃烧热是283.0 kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0 kJ•mol-1则是正确的,反应热的单位错了,故A错误;
B、强酸强碱的中和热为-57.3 kJ/mol,而Ba(OH)2(aq)+H2SO4(aq)=BaSO4(S)+2H2O(l)反应过程包括中和热和沉淀热,△H不是114.6 kJ,故B错误;
C、能量越高越不稳定,石墨转化为金刚石是吸热反应,所以金刚石能量高,则金刚石的燃烧热更大,故C正确;
D、对于反应2SO2+O2?2SO3,增大压强平衡正向移动,但反应热不变,故D错误;
故选C.
点评 本题考查了热化学方程式的书写方法,燃烧热、中和热的概念判断,关键是选项D的分析,平衡移动但反应热不变,题目难度中等.

练习册系列答案
相关题目
14.15g物质A和10.5g物质B完全反应,生成7.2g物质C、1.8g物质D和标准状况下6.72L的气态物质E,则物质E的摩尔质量是( )
| A. | 16.5 g/mol | B. | 85 g/mol | C. | 55 g/mol | D. | 27.5 g/mol |
15.下列物质不能与二氧化硅发生化学反应的是( )
| A. | CaO | B. | 氢氟酸 | C. | NaOH溶液 | D. | 浓硫酸 |
12.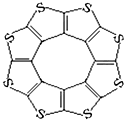 最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子.
最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子.
①元素电负性大小关系是:C<S(填“>”、“=”或“<”).
②分子中C原子的杂化轨道类型为sp2.
③有关键长数据如下:
从表中数据可以看出,C16S8中碳硫键键长介于C-S与C=S之间,原因可能是:分子中的C与S原子之间有π键或分子中的碳硫键具有一定程度的双键性质.
④C16S8与H2微粒间的作用力是范德华力.
 最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子.
最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子.①元素电负性大小关系是:C<S(填“>”、“=”或“<”).
②分子中C原子的杂化轨道类型为sp2.
③有关键长数据如下:
| C-S | C=S | C16S8中碳硫键 | |
| 键长/pm | 181 | 155 | 176 |
④C16S8与H2微粒间的作用力是范德华力.
19.从化学视角认识生产生活中的一些现象,其中错误的是( )
| A. | 打开汽水瓶盖时有大量气泡冒出,可用勒夏特列原理解释 | |
| B. | 用热的纯碱(Na2CO3)溶液容易洗去餐具上的油污 | |
| C. | 向牛奶中加入果汁会产生沉淀,这是因为酸碱发生了中和反应 | |
| D. | 用铁制自来水管与铜制水龙头连接使用时,连接处的铁水管锈蚀更快 |
9.下列物质与水反应,最终产物只有一种物质的是( )
| A. | 淀粉 | B. | 丙烯 | C. | 醋酸钠 | D. | 乙酸乙酯 |
16.a、b、c三种元素,a、b同周期,a、c同主族,它们原子的最外层电子数之和为16,则这三种元素可能是
( )
( )
| A. | P、S、N | B. | Cl、S、F | C. | S、Cl、O | D. | K、Ca、Na |
14.2015年2月28日,央视原记者柴静及其团队制作的视频《穹顶之下》引起了人们对环境保护的再思考,下列说法体现人与自然和谐相处的是( )
| A. | 将聚氯乙烯等塑料垃圾焚烧 | |
| B. | 推广矿物燃料脱硫技术以减少SO2等有害气体的排放 | |
| C. | 大力开采石油、煤、页岩气(主要成分为CH4)等化石燃料 | |
| D. | 电池使用后随意丢弃,无需处理 |
