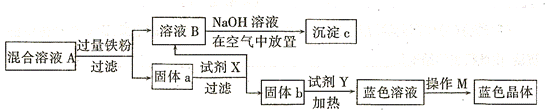
题目内容
(9分)按要求写出下列反应的化学方程式或离子方程式
(1)钢铁工业是国家工业的基础。请回答:
①写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
②在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。
写出铁粉和水蒸气反应的化学方程式:
(2)铝片放入NaOH溶液中有气体生成,写出反应的离子方程式:
(1)钢铁工业是国家工业的基础。请回答:
①写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
②在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。
写出铁粉和水蒸气反应的化学方程式:
(2)铝片放入NaOH溶液中有气体生成,写出反应的离子方程式:

略

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
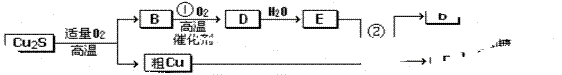
 适量的空气冶炼金属铜的化学方程式__________________________
适量的空气冶炼金属铜的化学方程式__________________________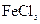 可用作印刷电路铜板腐蚀剂。
可用作印刷电路铜板腐蚀剂。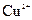 、
、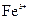 的浓度均为
的浓度均为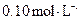 ,不考虑溶液体积的变化,则原
,不考虑溶液体积的变化,则原