题目内容
(1)一定条件下,可逆反应:A2(g)+B2(g)  2C(g)达到平衡时,各物质的
2C(g)达到平衡时,各物质的
平衡浓度分别为:c(A2)=0.5 mol·L-1;c(B2)=0.1 mol·L-1;c(C)=1.6 mol·L-1。
若用a、b、c分别表示A2、B2、C的初始浓度(mol·L-1),则:
①a、b应满足的关系式是 。
②a的取值范围是 。
(2)氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,肼(N2H4)可
作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)="===" N2O4 (1) △H1= -19.5kJ·mol-1
②N2H4(1)+O2(g)="===" N2(g)+2H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2O4反应的热化学方程式 ;
(1)①a=b+0.4 ②0.4<a<1.3
(2) 2N2H4(L)+N2O4(L)====3N2(g)+4H2O(g) △H=-1048.9kJ/mol(3分)
【解析】
试题分析:(1)一定条件下,可逆反应:A2(g)+B2(g)  2C(g)达到平衡时,各物质的平衡浓度分别为:c(A2)=0.5 mol·L-1;c(B2)=0.1 mol·L-1;c(C)=1.6 mol·L-1,若B2(g)完全反应,则a为0.4,即b为0,若C全部全部转化为A2(g)+B2(g),则a为1.3,b为0.9,所以①a、b应满足的关系式是a=b+0.4,而上述是假设状态,故a的取值范围是0.4<a<1.3;(2)肼和N2O4反应的热化学方程式可以由②N2H4(1)+O2(g)="==="
N2(g)+2H2O(g)乘以2,再减去①N2(g)+2O2(g)="===" N2O4得到,故肼和N2O4反应的热化学方程式为 2N2H4(L)+N2O4(L)====3N2(g)+4H2O(g△H=-1048.9kJ/mol,(△H=-534.2×2+19.5=-1048.9kJ/mol)。
2C(g)达到平衡时,各物质的平衡浓度分别为:c(A2)=0.5 mol·L-1;c(B2)=0.1 mol·L-1;c(C)=1.6 mol·L-1,若B2(g)完全反应,则a为0.4,即b为0,若C全部全部转化为A2(g)+B2(g),则a为1.3,b为0.9,所以①a、b应满足的关系式是a=b+0.4,而上述是假设状态,故a的取值范围是0.4<a<1.3;(2)肼和N2O4反应的热化学方程式可以由②N2H4(1)+O2(g)="==="
N2(g)+2H2O(g)乘以2,再减去①N2(g)+2O2(g)="===" N2O4得到,故肼和N2O4反应的热化学方程式为 2N2H4(L)+N2O4(L)====3N2(g)+4H2O(g△H=-1048.9kJ/mol,(△H=-534.2×2+19.5=-1048.9kJ/mol)。
考点:化学平衡的计算、热化学方程式的书写
点评:本题考查了化学平衡的计算、热化学方程式的书写,该考点是高考考查的热点,本题有利于培养学生对化学平衡计算的理解能力,该难度中等。

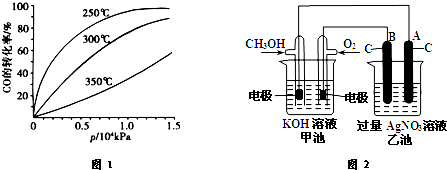
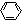 →
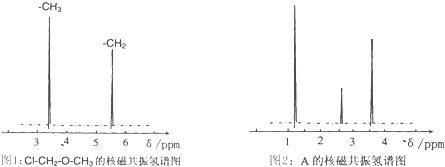
→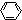 -CH2COOH+HCl
-CH2COOH+HCl