题目内容
将下列物质按照要求由高到低的顺序排列
(1)NaF、NaCl、冰醋酸、SiC四种物质的熔沸点顺序: 。
(2)C、N、O三种元素的第一电离能: 。
(3)H2O的相对分子质量比H2S小,但沸点却高的原因 。
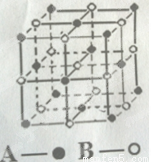
(4)某气态团簇分子的分子结构如图所示,其晶体的晶胞与CO2晶体的晶胞类型相同,则该团簇分子的分子式为 。
(1)SiC> NaF> NaCl>冰醋酸;
(2)N>O>C;
(3)水分子间存在氢键使分子间作用力增大,沸点升高;
(4)AB或BA。
【解析】
试题分析:(1)根据晶体类型的熔沸点的高低顺序,原子晶体>离子晶体>分子晶体,离子晶体中,离子半径越小,熔沸点越高。所以四种物质熔沸点由高到低的顺序SiC> NaF> NaCl>冰醋酸;
(2)同周期元素的第一电离能随核电荷数增加而增大,但是氮原子的最外层电子为半充满状态,比较稳定,所以第一电离能最大,因此C、N、O三种元素的第一电离能N>O>C;
(3)水分子间存在氢键使分子间作用力增大,沸点升高;
(4)由晶胞中原子个数的计算方法得该晶胞中有8×1/8+6×1/2=4个A,有12×1/4+1=4个B,所以AB的原子个数比为1:1,分子式为AB或BA。
考点:考查物质熔沸点的比较,第一电离能的判断,氢键的作用,由晶胞计算分子式

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目