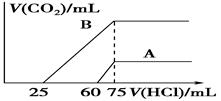
题目内容
(6分)在加热条件下,用二氧化锰与足量浓盐酸反应,制得氯气0.56L(标准状况)。问:
(1)理论上需要消耗MnO2多少克?
(2)被氧化的HCl的物质的量是多少?
(3)在反应中,电子转移的数目大约是多少?
(1)理论上需要消耗MnO2多少克?
(2)被氧化的HCl的物质的量是多少?
(3)在反应中,电子转移的数目大约是多少?
4HCl()+MnO2 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
4mol 87g 22.4L
n m 0.56L
(1)所以消耗二氧化锰的质量是m=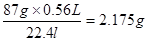
(2)参加反应的氯化氢是n=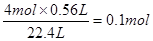
因为被氧化的氯化氢和参加反应的氯化氢是1︰2的
所以被氧化的HCl的物质的量是0.05mol
(3)反应中转移电子是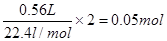
数目是0.05mol×6.02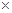 1023/mol=3.01
1023/mol=3.01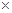 1022
1022
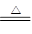 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O4mol 87g 22.4L
n m 0.56L
(1)所以消耗二氧化锰的质量是m=
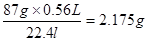
(2)参加反应的氯化氢是n=
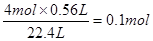
因为被氧化的氯化氢和参加反应的氯化氢是1︰2的
所以被氧化的HCl的物质的量是0.05mol
(3)反应中转移电子是
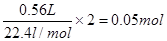
数目是0.05mol×6.02
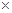 1023/mol=3.01
1023/mol=3.01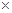 1022
1022考查根据化学方程式进行的有关计算。

练习册系列答案
相关题目