题目内容
假设双氧水(H2O2)是比碳酸还弱的二元酸。</PGN0031A.TXT/PGN>
(1)双氧水电离的方程式为___ _。
(2)若CO2与Na2O2不发生反应,而潮湿的CO2可与Na2O2反应,则该反应的化学方程式为:__ __。
(1)H2O2![]() HO2-+H+ HO2-
HO2-+H+ HO2-![]() O2-2+H+
O2-2+H+
(2)Na2O2+CO2+H2O==Na2CO3+H2O2
解析:
H2O2是比碳酸还弱的二元酸,只需迁移已学过的碳酸电离方程式就不难回答问题(1)。至于问题(2)只要仅仅抓住潮湿CO2中含水分可形成H2CO3,利用中学已学过的强酸与弱酸盐反应制弱酸的规律,就可写出该反应的化学方程式。

练习册系列答案
相关题目
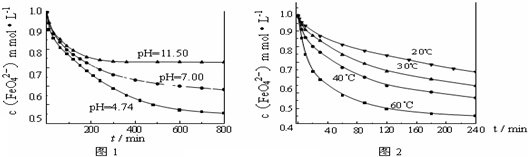


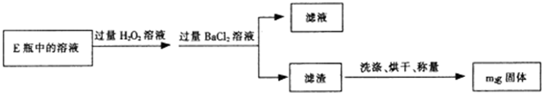
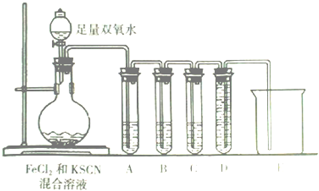 某化学兴趣小组进行“Fe2+”与“Fe3+”转化实验:向FeCl2溶液中加入少量KSCN溶液,溶液无明显变化,再加入少量双氧水,溶液变红,继续滴加至过量,发现溶液红色褪去,同时有气泡生成.他们针对此异常现象展开探究,请回答有关问题:
某化学兴趣小组进行“Fe2+”与“Fe3+”转化实验:向FeCl2溶液中加入少量KSCN溶液,溶液无明显变化,再加入少量双氧水,溶液变红,继续滴加至过量,发现溶液红色褪去,同时有气泡生成.他们针对此异常现象展开探究,请回答有关问题: