题目内容
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述正确的是( )
H++CH3COO-,下列叙述正确的是( )
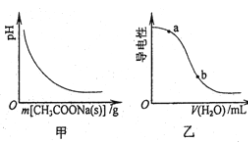
A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
D.0.10mol·L-1的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
【答案】C
【解析】
试题分析:A.CH3COOH溶液中存在醋酸的电离平衡,逐步加入CH3COONa固体后,增大了醋酸根离子的浓度,抑制醋酸的电离,溶液pH逐渐增大,故A错误;B.a点导电性大于b点,表示溶液中的离子浓度较大,则c(H+)a点大于b点,pH:a<b,故B错误;C.根据电荷守恒,醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-),故C正确;D.0.10mol·L-1的CH3COOH溶液中加水稀释,溶液中c(H+)减小,温度不变,Kw不变,则c(OH-)增大,故D错误;故选C。

【题目】用98%的浓硫酸(ρ=1.84g/cm3)配制1mol/L稀硫酸100mL.
(1)实验中应选用的仪器是 (填字母).
A.1000mL量筒 |
B.托盘天平 |
C.玻璃棒 |
D.50mL容量瓶 |
E.10mL量筒
F.50mL烧杯
G.100mL容量瓶
H.胶头滴管
(2)实验操作:
a.用100mL量筒量取98%的浓硫酸 mL;
b.选取对应规格的容量瓶,洗涤,检查是否漏液,将稀释并冷却至室温的硫酸溶液沿玻璃棒转移到此容量瓶中;
c.用少量蒸馏水洗涤小烧杯和玻璃棒2--3次,并将洗涤液转移到容量瓶中;
d.在小烧杯内稀释浓硫酸,稀释时要用玻璃棒不断搅拌;
e.向容量瓶中直接加蒸馏水至离刻度线1---2cm处;
f.盖上容量瓶瓶塞,摇匀;
g.用胶头滴管小心加蒸馏水至刻度线;
h.将配制好的溶液转移入含少量蒸馏水的试剂瓶中贮存备用.
(3)实验分析:
①正确的操作步骤是 (填序号).
②此实验中玻璃棒的作用是 .
③实验操作中有两处错误,这两处错误是:
I. .
II. .
④下列操作对所配溶液的浓度有何影响?(填“偏高”“偏低”或“无影响”)
I.转移硫酸后,小烧杯未洗涤 .
II.量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶中 .
III.定容时俯视容量瓶刻度线 .


