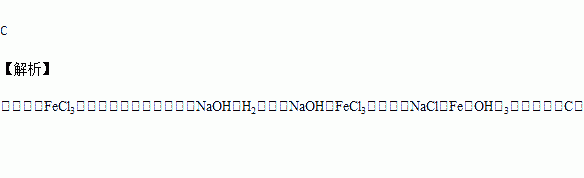题目内容
将一小块钠投入到FeCl3溶液中,观察到的现象是( )
A. 钠溶解,有铁析出并有气体产生
B. 只有气体产生
C. 既有气体产生,又有红褐色沉淀产生
D. 只有沉淀产生
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 、MgO、CaO等,生产工艺流程示意如下:

请回答下列问题:
(1)将菱锌矿研磨成粉的目的是:______________________________。
(2)漂白粉的有效成分是NaClO,请完成“氧化除铁”步骤中反应的离子方程式:_______________________
□Fe(OH)2+ □ClO- + □_____= □Fe(OH)3 + □ Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,相对分子质量为89,化学式是____________(不用考虑化学式中各元素的排列顺序)。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为________________。
Mg(OH)2 | Zn(OH)2 | |
开始沉淀的pH | 10.4 | 6.4 |
沉淀完全的pH | 12.4 | 8.0 |
开始溶解的pH | — | 10.5 |
(5)假设各步转化均完全,分析图中数据可知:菱锌矿粉中ZnCO3的质量是_____________。
在Na+浓度为0.9mol﹒L-1的某澄清溶液中,还可能含有下表中中的若干种离子:取该溶液100mL进行如下实验(气体体积在标准状况下测定):
阳离子 | K+、Ag+、Mg2+、Ba2+ |
阴离子 | NO3-、CO32-、SiO32-、SO42- |
Ⅰ.向该溶液中加入足量稀HCl,产生白色沉淀并放出1.12L气体
Ⅱ.将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量固体质量为3.6g
Ⅲ.在Ⅱ的滤液中滴加BaC12溶液,无明显现象。下列说法不正确的是
A. K+一定存在,且c(K+ )≤1.3mol • L-1
B. 实验I能确定一定不存在的离子是Ag+、Mg2+、Ba2+
C. 实验I中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓
D. 实验Ⅲ能确定一定不存在SO42-