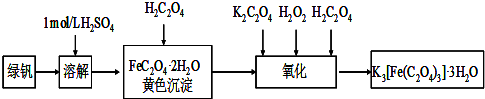
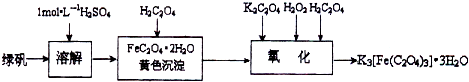
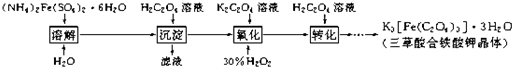
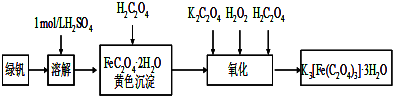
题目内容
三草酸合铁酸钾晶体[K3Fe(C2O4)3?xH2O]是一种光敏材料,为测定该晶体中草酸根的含量和结晶水的含量,某实验小组实验步骤为:
(1)称量9.820g三草酸合铁酸钾晶体,配制成250mL溶液.
(2)取所配溶液25.00mL于锥形瓶中,滴加酸性KMnO4溶液至C2O42-全部转化成CO2,同时MnO4-被转化成Mn2+,恰好消耗0.1000mol/LKMnO4溶液24.00mL.[K3Fe(C2O4)3的相对分子质量为437]
下列说法正确的是( )
(1)称量9.820g三草酸合铁酸钾晶体,配制成250mL溶液.
(2)取所配溶液25.00mL于锥形瓶中,滴加酸性KMnO4溶液至C2O42-全部转化成CO2,同时MnO4-被转化成Mn2+,恰好消耗0.1000mol/LKMnO4溶液24.00mL.[K3Fe(C2O4)3的相对分子质量为437]
下列说法正确的是( )
分析:A、根据化合价变化,高锰酸钾中的锰原子化合价降低,被还原;
B、必须使用到250mL的容量瓶和胶头滴管;
C、根据电子守恒计算出C2O42- 的物质的量,再求出三草酸合铁酸钾的质量,最后计算出结晶水的物质的量;
D、根据求算出的草酸跟的物质的量和结晶水的物质的量,算出结晶水的个数.
B、必须使用到250mL的容量瓶和胶头滴管;
C、根据电子守恒计算出C2O42- 的物质的量,再求出三草酸合铁酸钾的质量,最后计算出结晶水的物质的量;
D、根据求算出的草酸跟的物质的量和结晶水的物质的量,算出结晶水的个数.
解答:解:A、同时MnO4-被转化成Mn2+,锰元素化合价由+7→+2,化合价降低被还原,作氧化剂,故A错误;
B、需要配制成250mL溶液,必须使用到250容量瓶和胶头滴管,故B错误;
C、高锰酸钾得到电子等于C2O42-失去的电子,n得=0.1000mol/L×0.024L×(7-2)=0.012mol;
C2O42-全部转化成CO2,化合价变化+3→+4,根据电子守恒 n(C2O42-)=
=0.006mol;
250mL原溶液C2O42-的物质的量为0.006mol×10=0.06mol,故n[K3Fe(C2O4)3]=0.06mol×
=0.02mol,
9.820g三草酸合铁酸钾晶体中结晶水的质量为:9.820-437×0.02=1.08(g),故n(H2O)=
=0.06mol,故C错误;
D、根据C项计算结果,0.02molK3Fe(C2O4)3中还有0.06molH2O,结晶水数目为3,故该晶体的化学式为K3Fe(C2O4)3?3H2O,故D正确;
故选D.
B、需要配制成250mL溶液,必须使用到250容量瓶和胶头滴管,故B错误;
C、高锰酸钾得到电子等于C2O42-失去的电子,n得=0.1000mol/L×0.024L×(7-2)=0.012mol;
C2O42-全部转化成CO2,化合价变化+3→+4,根据电子守恒 n(C2O42-)=
| 0.012mol |
| (2-1)×2 |
250mL原溶液C2O42-的物质的量为0.006mol×10=0.06mol,故n[K3Fe(C2O4)3]=0.06mol×
| 1 |
| 3 |
9.820g三草酸合铁酸钾晶体中结晶水的质量为:9.820-437×0.02=1.08(g),故n(H2O)=
| 1.08g |
| 18g.mol-1 |
D、根据C项计算结果,0.02molK3Fe(C2O4)3中还有0.06molH2O,结晶水数目为3,故该晶体的化学式为K3Fe(C2O4)3?3H2O,故D正确;
故选D.
点评:本题借助滴定,考查学生分析、理解信息能力及计算能力,该题难度稍大,需要耐心分析题中数据.

练习册系列答案
相关题目