题目内容
(1)将等质量的Zn粉分别投入:a:10 mL 0.1 mol·L-1 HCl和
b:10 mL 0.1 mol·L-1醋酸中。(填“>”、“=”或“<”)
①若Zn不足量,则反应速率a b,
②若Zn过量,产生H2的量a b。
(2)将等质量的Zn粉分别投入pH=1,体积均为10 mL的a:盐酸b:醋酸中
①若Zn不足量,则起始反应速率a b,
②若Zn过量,产生H2的量a b。
(1)①> ②= (2)①= ②<
解析

练习册系列答案
相关题目
下列物质中,属于强电解质的是 (填序号,下同);属于弱电解质的是 ;属于非电解质的是 。
①氨气;②氨水;③盐酸;④醋酸(CH3COOH);⑤硫酸钡;⑥氯化银;⑦氯化钠溶液;⑧二氧化碳;⑨醋酸铵;⑩氢气
依据题目要求回答下列问题。
(1)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如表所示。
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②根据表中数据,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是 (填字母编号,下同);将各溶液分别稀释100倍,pH变化最小的是 。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③根据上表数据,请你判断下列反应不能成立的是 。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+NaClO=NaHCO3+HClO
D.CO2+H2O+2C6H5Ona=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为 。
(2)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液中c(Cu2+)="0.02" mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液的pH大于 。
25 ℃时,电离平衡常数:
| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数(25 ℃) | 1.8×10-5 | 3.0×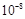 | K1=4.3×10-7 K2=5.6×10-11 |
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质:
a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;
pH由大到小的顺序是 (填编号)。
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是 ;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
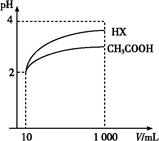
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图,则HX的电离平衡常数 (填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是 ,
稀释后,HX溶液中水电离出来的c(H+) (填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是 ;
(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)= (填准确数值)。
以下是25℃时几种难溶电解质的溶解度:
| 难容电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,加入一定量的试剂反应,过滤后结晶。
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的Mg(OH)2,充分反应,过滤后结晶。
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤后结晶。
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe2+、Fe3+都被转化为 而除去。
(2)①中加入的试剂应该选择 为宜。
(3)②中除去Fe3+所发生的总反应的离子方程式为 。
(4)下列与方案③相关的叙述中,正确的是 (填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
(1)①25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示。反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 。 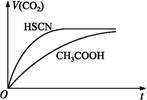
反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”“<”或“=”)。
②若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是 (填序号)。
| A.c(CH3COO-) | B.c(H+) | C.KW | D.醋酸电离平衡常数 |
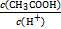
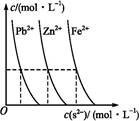
(2)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10 mL 0.01 mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ,c(H2C2O4) c(C2
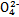 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。 

 的值 (填“增大”、“减小”或“不变”)。
的值 (填“增大”、“减小”或“不变”)。