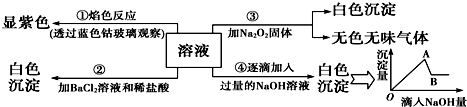
题目内容
19.设反应A═D+E△H-T△S=(-4500+11T ) J•mol-1,要防止反应发生,温度必须( )| A. | 高于409 K | B. | 低于136 K | ||
| C. | 高于136 K而低于409 K | D. | 低于409 K |
分析 反应是否自发进行的判断依据是△H-T△S,△H-T△S<0,反应自发进行,△H-T△S>0,反应不能自发进行,据此解答.
解答 解:要使反应不能自发进行需满足:△H-T△S>0,即:(-4 500+11T ) J•mol-1>0,解得:T>409K,
故选:A.
点评 本题考查了反应自发进行的判断依据的计算应用,题目难度不大.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
7.下列有关原电池的说法正确的是( )
| A. | 将反应2Fe3++Fe═3Fe2+设计为原电池,则可用Zn为负极,Fe为正极,FeCl3为电解质 | |
| B. | 铜片和铝片用导线连接后插入浓硝酸中,铜作负极 | |
| C. | 镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀 | |
| D. | 铝片和镁片用导线连接后插入NaOH溶液中,Mg较活泼作负极 |
4.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 25℃时,1L 0.1mol/L的CH3COOH溶液中的H+数为0.1NA | |
| B. | 常温常压下,30g葡萄糖含有的氧原子数为NA | |
| C. | 0.1mol/L的AlCl3溶液中含有的氯离子数为0.3NA | |
| D. | 16 g甲烷分子中含有共价键的数目为2NA |
11.下列事实不能用勒夏特列原理解释的是( )
| A. | 工业制取金属钾:Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| B. | 配制氯化铁溶液时,将氯化铁加入盐酸中,然后加水稀释 | |
| C. | 向氯水中加CaCO3后,溶液漂白性增强 | |
| D. | 二氧化氮与四氧化二氮的平衡体系,加压缩小体积后颜色加深 |
9.Na、Mg、Al、Fe四种金属中两种组成的混合物12g,与足量盐酸反应放出氢气0.5g,则混合物中必定含有的金属是( )
| A. | Na | B. | Mg | C. | Al | D. | Fe |
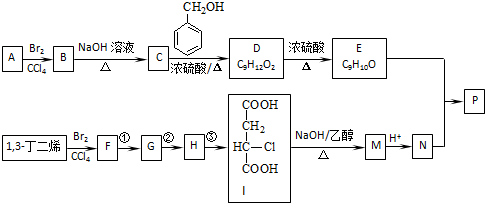
 (R1~R4表示氢或烃基)
(R1~R4表示氢或烃基)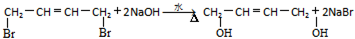 .
.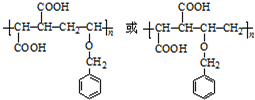 .
.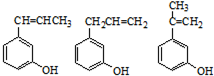 (其中任一种).
(其中任一种).