题目内容
【题目】下图中甲、乙是电化学实验装置图,丙是氯碱工业生产示意图。
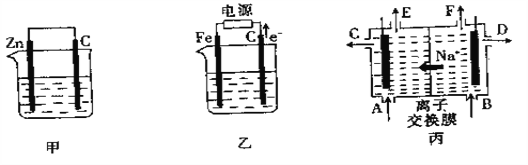
(1)若甲、乙两装置的烧杯中均盛有![]() 溶液,反应一段时间后:
溶液,反应一段时间后:
①表面有红色物质析出的电极是:甲装置中的_______棒,乙装置中的________棒。
②乙装置中碳棒表面发生的电极反应式是______________________。
③若起始时乙中盛放100 mL ![]() 溶液,一段时间后要使溶液恢复到起始时的浓度(忽略溶液体积的变化),可向溶液中加入2.22g的碱式碳酸【Cu2(OH)2CO3】,则电解过程中转移电子数为______________
溶液,一段时间后要使溶液恢复到起始时的浓度(忽略溶液体积的变化),可向溶液中加入2.22g的碱式碳酸【Cu2(OH)2CO3】,则电解过程中转移电子数为______________
(2)若甲、乙两装置的烧杯中均盛有饱和NaCl溶液;
①写出甲装置中碳棒表面发生的电极反应式:______________________________。
②已知: ![]() ,将湿润的淀粉KI试纸放在乙装置的碳棒附近,现象为__________________________。
,将湿润的淀粉KI试纸放在乙装置的碳棒附近,现象为__________________________。
③工业上经常用到离子交换膜,离子交换膜有阳离子交换膜和阴离子交换膜两种,阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。当乙中的反应用于工业生产时,为了阻止两极产物之间的反应,通常用如丙图所示的装置, ![]() 的移动方向如图中标注,则
的移动方向如图中标注,则![]() 的出口是_______(填“C”、“D”、“E”或“F”);电解一段时间后,如果阴极产生气体的体为112 mL(标准状况)时,停止通电,通过阳离子交换膜的阳离子物质的量为______ mol。
的出口是_______(填“C”、“D”、“E”或“F”);电解一段时间后,如果阴极产生气体的体为112 mL(标准状况)时,停止通电,通过阳离子交换膜的阳离子物质的量为______ mol。
【答案】 C或者碳 Fe或者铁 4OH—-4e— =O2+2H2O 0.06NA ![]() 试纸开始变蓝,一段时间后蓝色褪去(合理即可) E 0.01
试纸开始变蓝,一段时间后蓝色褪去(合理即可) E 0.01
【解析】(1)①甲装置是原电池,锌是负极,碳棒是正极,溶液中的铜离子得到电子,表面有红色物质析出的电极是碳;乙装置是电解池,根据电子的流向可知碳电极阳极,铁电极是阴极,溶液中的铜离子放电,表面有红色物质。②乙装置中碳棒是阳极,溶液中的氢氧根放电,表面发生的电极反应式是 4OH—-4e—=O2+2H2O。③2.22g碱式碳酸的物质的量是2.22g÷222g/mol=0.01mol,根据Cu和H的物质的量可知转移电子的物质的量是0.01mol×2×2+0.01mol×2×1=0.06mol;(2)①写出甲装置中锌发生吸氧腐蚀,碳棒表面发生的电极反应式为O2+4e-+2H2O=4OH-。②乙装置碳电极是阳极,氯离子放电生成氯气,氯气能把碘离子氧化为单质碘,进而把碘氧化为碘酸,所以将湿润的淀粉KI试纸放在乙装置的碳棒附近,现象为试纸开始变蓝,一段时间后蓝色褪去;③钠离子向左侧移动,说明左侧是阴极室,氢离子放电产生氢气,因此氢气的出口是E;电解一段时间后,阴极产生气体的体积为112 mL(标准状况)即氢气是0.005mol,消耗氢离子是0.01mol,根据电荷守恒可知通过阳离子交换膜的阳离子物质的量为0.01mol。

【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。回答下列问题:
(l)ClO2的制备:(已知:SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4)
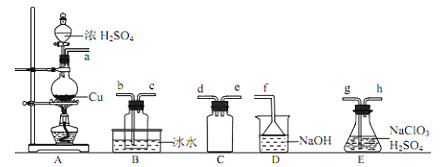
①装置A中反应的化学方程式为_______________。
②欲收集干燥的ClO2,选择上图中的装置,其连接顺序为 a→_________(按气流方向,用小写字母表示)
③装置D的作用是_________。
(2)ClO2与 Na2S 的反应
将上述收集到的ClO2用 N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入上图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究 I 中反应的产物。
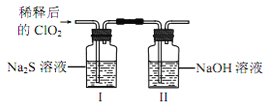
操作步骤 | 实验现象 | 结论 |
取少量Ⅰ中溶液于试管甲中, 加入Ba(OH)2溶液,振荡 | ①_________ | 有硫酸根离子生成 |
另取少量Ⅰ中溶液于试管乙中, 滴加品红溶液和盐酸 | 品红溶液不翅色 | ② 无_____生成 |
若在试管甲中继续加Ba(OH)2溶液至 过量,静置,取上层清液于试管丙③______ | 有白色沉淀生成 | 有Cl-生成 |
④ClO2与Na2S反应的离子方程式为__________。用于处理含硫废水时,ClO2相对于Cl2的优点是____________(任写2条)。