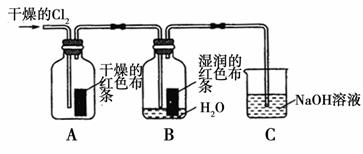
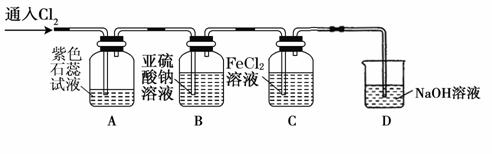
题目内容
某厂废水中含5.00×10-3 mol·L-1的Cr2O ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:
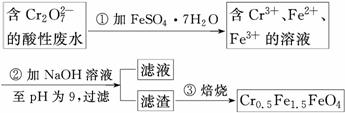
(1)第①步反应的离子方程式是___________________________________________
____________________________________________________ ____________________。
____________________。
(2)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有__________。
(3)欲使1 L该废水中的Cr2O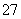 完全转化为Cr0.5Fe1.5FeO4。理论上需要加入________g FeSO4·7H2O。
完全转化为Cr0.5Fe1.5FeO4。理论上需要加入________g FeSO4·7H2O。
解析:(1)第①步是Cr2O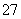 与Fe2+发生氧化还原反应,离子方程式为:Cr2O
与Fe2+发生氧化还原反应,离子方程式为:Cr2O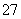 +6Fe2++14H+===2Cr3++6Fe3++7H2O;(2)从最终所得磁性材料的化学式可知,滤渣中主要有Cr(OH)3、Fe(OH)2、Fe(OH)3;(3)1 L废水中的n(Cr2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O;(2)从最终所得磁性材料的化学式可知,滤渣中主要有Cr(OH)3、Fe(OH)2、Fe(OH)3;(3)1 L废水中的n(Cr2O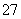 )=5.00×10-3mol,根据关系式:Cr2O
)=5.00×10-3mol,根据关系式:Cr2O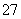 ~4Cr0.5Fe1.5FeO4~10FeSO4·7H2O,所以理论上n(FeSO4·7H2O)=0.05 mol,m(FeSO4·7H2O)=0.05 mol×278 g·mol-1=13.9 g。
~4Cr0.5Fe1.5FeO4~10FeSO4·7H2O,所以理论上n(FeSO4·7H2O)=0.05 mol,m(FeSO4·7H2O)=0.05 mol×278 g·mol-1=13.9 g。
答案:(1)Cr2O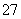 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
(2)Fe(OH)3、Fe(OH)2
(3)13.9

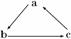
下列各组物质中,不能按如图所示关系一步完成转化的是( )
| A | B | C | D | |
| a | CO2 | H2SO4 | Al(OH)3 | HNO3 |
| b | Na2CO3 | SO2 | NaAlO2 | NO |
| c | NaHCO3 | SO3 | Al2O3 | NO2 |
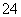 ===BaSO4↓
===BaSO4↓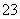 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O