题目内容
【题目】某兴趣小组用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入右图装置(电极均为惰性材料)进行实验。下列说法正确的是
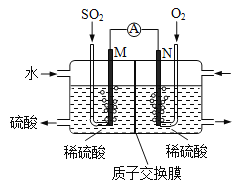
A. N极为负极
B. 反应一段时间后,左侧电解质溶液的pH增大
C. M极发生的电极反应为SO2+2H2O-2e-=SO42-+4H+
D. 在相同条件下,M、N两极上消耗的气体体积之比为1:2
【答案】C
【解析】该装置为原电池。N极上氧气发生还原反应,电极反应式:O2+4H++4e-==2H2O,为原电池的正极,M极上SO2发生氧化反应,电极反应式:SO2+2H2O-2e-==4H++SO42-,为原电池的负极。A. N极上氧气发生还原反应,电极反应式:O2+4H++4e-==2H2O,为原电池的正极,错误;B. M极上SO2发生氧化反应,电极反应式:SO2+2H2O-2e-==4H++SO42-,反应一段时间后,左侧电解质溶液的pH减小,错误;C. M极发生的电极反应为SO2+2H2O-2e-=SO42-+4H+,正确;D. 根据两极上的电极反应式和电子守恒判断在相同条件下,M、N两极上消耗的气体体积之比为2:1,错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目