题目内容
计算以下数值(均为25℃时)
(1)5×10-5mol/L的Ba(OH)2溶液的pH=
(2)某浓度的NH3?H2O溶液中,由水电离的c(H+)=1×10-12mol/L,该溶液的 pH=
(3)PH=11的NaOH溶液稀释100倍,所得溶液的PH=
(4)将pH=3的H2SO4 溶液和pH=12的NaOH溶液混合,混合后所得溶液的PH=10,则H2SO4 溶液与NaOH溶液的体积比为
(1)5×10-5mol/L的Ba(OH)2溶液的pH=
10
10
(2)某浓度的NH3?H2O溶液中,由水电离的c(H+)=1×10-12mol/L,该溶液的 pH=
12
12
(3)PH=11的NaOH溶液稀释100倍,所得溶液的PH=
9
9
(4)将pH=3的H2SO4 溶液和pH=12的NaOH溶液混合,混合后所得溶液的PH=10,则H2SO4 溶液与NaOH溶液的体积比为
9:1
9:1
.分析:(1)先计算氢氧根离子浓度,再根据离子积常数计算氢离子浓度,从而得出溶液的pH;
(2)碱溶液抑制水电离,溶液中氢离子全部是水电离的,根据氢离子浓度计算溶液的PH;
(3)强碱溶液稀释100倍,其浓度变为原来的
;
(4)pH=3的H2SO4 溶液中氢离子浓度为10-3mol/L,pH=12的NaOH溶液中氢氧根离子浓度为10-2mol/L,二者混合后所得溶液的PH=10,则混合溶液中氢氧根离子浓度为10-4mol/L,根据混合溶液的pH进行计算.
(2)碱溶液抑制水电离,溶液中氢离子全部是水电离的,根据氢离子浓度计算溶液的PH;
(3)强碱溶液稀释100倍,其浓度变为原来的
| 1 |
| 100 |
(4)pH=3的H2SO4 溶液中氢离子浓度为10-3mol/L,pH=12的NaOH溶液中氢氧根离子浓度为10-2mol/L,二者混合后所得溶液的PH=10,则混合溶液中氢氧根离子浓度为10-4mol/L,根据混合溶液的pH进行计算.
解答:解:(1)该溶液中氢氧根离子浓度=5×10-5mol/L×2=10-4mol/L,则氢离子浓度=
mol/L=10-10mol/L,则溶液的pH=10,故答案为:10;
(2)碱溶液抑制水电离,溶液中氢离子全部是水电离的,则溶液的pH=12,故答案为:12;
(3)强碱溶液稀释100倍,其浓度变为原来的
,其pH减少2个单位,所以其pH=11-2=9,
故答案为:9;
(4)pH=3的H2SO4 溶液中氢离子浓度为10-3mol/L,pH=12的NaOH溶液中氢氧根离子浓度为10-2mol/L,二者混合后所得溶液的PH=10,则混合溶液中氢氧根离子浓度为10-4mol/L,
设硫酸的体积为x,氢氧化钠溶液的体积为y,
混合溶液氢氧根离子浓度=
=10-4,x:y=9:1,
故答案为:9:1.
| 10-14 |
| 10-4 |
(2)碱溶液抑制水电离,溶液中氢离子全部是水电离的,则溶液的pH=12,故答案为:12;
(3)强碱溶液稀释100倍,其浓度变为原来的
| 1 |
| 100 |
故答案为:9;
(4)pH=3的H2SO4 溶液中氢离子浓度为10-3mol/L,pH=12的NaOH溶液中氢氧根离子浓度为10-2mol/L,二者混合后所得溶液的PH=10,则混合溶液中氢氧根离子浓度为10-4mol/L,
设硫酸的体积为x,氢氧化钠溶液的体积为y,
混合溶液氢氧根离子浓度=
| 10-2y-10-3x |
| x+y |
故答案为:9:1.
点评:本题考查了溶液pH的计算,易错选项是(2),注意碱溶液中水电离出的氢氧根离子和溶液中氢氧根离子的区别,为易错点.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案
相关题目

 B(g)+ C(g)分别在三种不同实验条件下进行,但起始浓度相同,均为c(A)=0.100mol/L、c(B)=0.020mol/L及c(C)=0.020mol/L。反应物A的浓度随时间的变化如下图所示:
B(g)+ C(g)分别在三种不同实验条件下进行,但起始浓度相同,均为c(A)=0.100mol/L、c(B)=0.020mol/L及c(C)=0.020mol/L。反应物A的浓度随时间的变化如下图所示: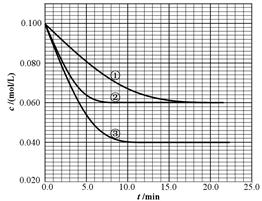
 B(g)+ C(g)分别在三种不同实验条件下进行,但起始浓度相同,均为c(A)=0.100mol/L、c(B)=0.020mol/L及c(C)=0.020mol/L。反应物A的浓度随时间的变化如下图所示:
B(g)+ C(g)分别在三种不同实验条件下进行,但起始浓度相同,均为c(A)=0.100mol/L、c(B)=0.020mol/L及c(C)=0.020mol/L。反应物A的浓度随时间的变化如下图所示: