题目内容
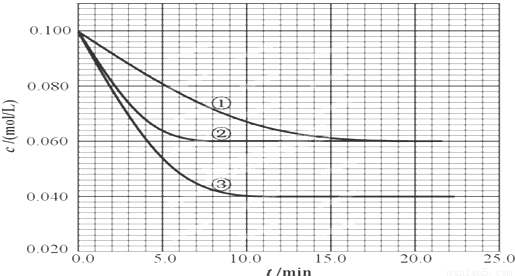
在2.00L的密闭容器中,反应2A(g)?B(g)+C(g)分别在三种不同实验条件下进行,但起始浓度相同,均为c(A)=0.100mol/L、c(B)=0.020mol/L及c(C)=0.020mol/L.反应物A的浓度随时间的变化如下图所示:请回答下列问题:
(1)以下说法能说明该反应已达到平衡状态的是:______(填序号)
①c(A):c(B):c(C)=2:1:1
②v(A)=2v(B)
③体系的压强不再改变
④A的质量分数不再改变
⑤混合气体的密度不再改变
(2)根据实验③回答:反应开始到4.0min时反应物A的转化率为______,B平均反应速率为______.
(3)与①比较,②和③分别仅改变一种反应条件.所改变的条件是:②______;③______.
(4)实验①条件下该反应的化学平衡常数值是______.若实验①到达平衡后,维持体系温度不变,往容器中再投入0.028mol B和0.028mol C,求新平衡时体系中A的物质的量浓度.(写出计算过程)
【答案】分析:(1)根据在一定条件下,当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理性也不变,注意该反应中,反应前后气体的化学计量数之和相等,压强不可作为判断的依据;
(2)根据转化率的概念计算;根据平衡三部曲进行计算物质的浓度,然后根据反应速率的计算公式计算;
(3)根据催化剂对化学反应速度率和化学平衡的影响;根据温度对化学反应速度率和化学平衡的影响,在溶液中,压强对化学平衡无影响;
(4)根据平衡三部曲进行计算物质的浓度,然后代入平衡常数表达式K=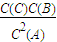 计算;根据平衡常数只与温度有关,设转化的B的物质的量浓度为x,运用三部曲进行计算物质的浓度,然后解出x来解答.
计算;根据平衡常数只与温度有关,设转化的B的物质的量浓度为x,运用三部曲进行计算物质的浓度,然后解出x来解答.
解答:解:(1)①平衡时各物质的物质的量的多少取决于起始量与转化的程度,不能作为判断达到平衡的依据,故错误;
②任何时候,v(A)=2v(B),不能作为判断达到平衡的依据,故错误;
③反应前后气体的化学计量数之和相等,压强不可作为判断的依据,故正确;
④A的质量分数不再改变,能作为判断达到平衡的依据,故正确;
⑤任何时候,混合气体的质量不再发生变化,容器的体积不变,导致混合气体的密度不再变化,所以不能作为判断达到平衡的依据,故错误;
故选:④;
(2)实验②平衡时B的转化率为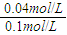 %=40%;
%=40%;
2A(g)?B(g)+C(g)
初始 (mol/L) 0.1 0.02 0.02
转化 (mol/L) 0.04 0.02 0.02
4.0min(mol/L) 0.06 0.04 0.04
则B平均反应速率为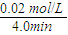 =0.005mol/(L?min),
=0.005mol/(L?min),
故答案为:40%;0.005mol/(L?min);
(3)因催化剂能加快化学反应速度率,缩短达到平衡的时间,化学平衡不移动,所以②为使用催化剂;因升高温度,化学反应速度率加快,化学平衡移动,平衡时A的浓度减小,故答案为:加催化剂;温度升高;
(4)2A(g)?B(g)+C(g)
初始 (mol/L) 0.1 0.02 0.02
转化 (mol/L) 0.04 0.02 0.02
平衡(mol/L) 0.06 0.04 0.04
平衡常数表达式K=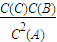 =
= =
= ;
;
往体系中再投入0.028molB和0.028molC后,平衡向左移动,设转化的B的物质的量浓度为x
2A (g)?B(g)+C (g)
旧平衡(mol/L) 0.060 0.040 0.040
新起始(mol/L) 0.060 0.040+0.014 0.040+0.014
转化(mol./L) 2x x x
新平衡(mol/L) 0.060+2x 0.054-x 0.054-x
K=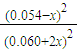 =
= x=0.006mol/L;
x=0.006mol/L;
再次达到平衡时A的物质的量浓度:c(A)=(0.060+0.006×2)mol/L=0.072 mol/L;
故答案为: ;0.072 mol/L.
;0.072 mol/L.
点评:本题主要考查了平衡状态的判断,平衡常数的计算,注意三段法计算的应用,难度中等.
(2)根据转化率的概念计算;根据平衡三部曲进行计算物质的浓度,然后根据反应速率的计算公式计算;
(3)根据催化剂对化学反应速度率和化学平衡的影响;根据温度对化学反应速度率和化学平衡的影响,在溶液中,压强对化学平衡无影响;
(4)根据平衡三部曲进行计算物质的浓度,然后代入平衡常数表达式K=
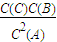 计算;根据平衡常数只与温度有关,设转化的B的物质的量浓度为x,运用三部曲进行计算物质的浓度,然后解出x来解答.
计算;根据平衡常数只与温度有关,设转化的B的物质的量浓度为x,运用三部曲进行计算物质的浓度,然后解出x来解答.解答:解:(1)①平衡时各物质的物质的量的多少取决于起始量与转化的程度,不能作为判断达到平衡的依据,故错误;
②任何时候,v(A)=2v(B),不能作为判断达到平衡的依据,故错误;
③反应前后气体的化学计量数之和相等,压强不可作为判断的依据,故正确;
④A的质量分数不再改变,能作为判断达到平衡的依据,故正确;
⑤任何时候,混合气体的质量不再发生变化,容器的体积不变,导致混合气体的密度不再变化,所以不能作为判断达到平衡的依据,故错误;
故选:④;
(2)实验②平衡时B的转化率为
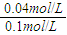 %=40%;
%=40%;2A(g)?B(g)+C(g)
初始 (mol/L) 0.1 0.02 0.02
转化 (mol/L) 0.04 0.02 0.02
4.0min(mol/L) 0.06 0.04 0.04
则B平均反应速率为
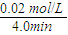 =0.005mol/(L?min),
=0.005mol/(L?min),故答案为:40%;0.005mol/(L?min);
(3)因催化剂能加快化学反应速度率,缩短达到平衡的时间,化学平衡不移动,所以②为使用催化剂;因升高温度,化学反应速度率加快,化学平衡移动,平衡时A的浓度减小,故答案为:加催化剂;温度升高;
(4)2A(g)?B(g)+C(g)
初始 (mol/L) 0.1 0.02 0.02
转化 (mol/L) 0.04 0.02 0.02
平衡(mol/L) 0.06 0.04 0.04
平衡常数表达式K=
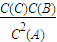 =
= =
= ;
;往体系中再投入0.028molB和0.028molC后,平衡向左移动,设转化的B的物质的量浓度为x
2A (g)?B(g)+C (g)
旧平衡(mol/L) 0.060 0.040 0.040
新起始(mol/L) 0.060 0.040+0.014 0.040+0.014
转化(mol./L) 2x x x
新平衡(mol/L) 0.060+2x 0.054-x 0.054-x
K=
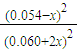 =
= x=0.006mol/L;
x=0.006mol/L;再次达到平衡时A的物质的量浓度:c(A)=(0.060+0.006×2)mol/L=0.072 mol/L;
故答案为:
 ;0.072 mol/L.
;0.072 mol/L.点评:本题主要考查了平衡状态的判断,平衡常数的计算,注意三段法计算的应用,难度中等.

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
广东省近几年来的乙烯产量一直居全国之首.工业上常用乙烷裂解制取乙烯:C2H6(g)?C2H4(g)+H2(g)△H
回答下列问题:
(1)C2H6分子中,存在的共价键类型有: .
(2)下表为一些共价键在断裂(或生成)时,所吸收(或放出)的能量:
上述反应的△H= .
(3)将1.00mol乙烷充入容积为1.00L的恒容密闭容器,一定温度下发生反应,平衡时测得乙烷的物质的量为0.20mol.求该温度下反应的平衡常数及乙烷的平衡转化率.(写出计算过程)
(4)实际生产中,常在恒温恒压下采用加入水蒸气的方法来提高乙烯的产率(水蒸汽在此条件下不参与反应),原因是 .
回答下列问题:
(1)C2H6分子中,存在的共价键类型有: .
(2)下表为一些共价键在断裂(或生成)时,所吸收(或放出)的能量:
| 化学键 | H-H | C-H | C-C | C=C |
| 吸收或放出的能量 E/(kJ.mol-1) | 435.3 | 414.4 | 345.6 | 615.3 |
(3)将1.00mol乙烷充入容积为1.00L的恒容密闭容器,一定温度下发生反应,平衡时测得乙烷的物质的量为0.20mol.求该温度下反应的平衡常数及乙烷的平衡转化率.(写出计算过程)
(4)实际生产中,常在恒温恒压下采用加入水蒸气的方法来提高乙烯的产率(水蒸汽在此条件下不参与反应),原因是 .