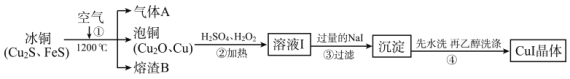
题目内容
【题目】氨基甲酸铵(NH2COONH4)是治疗某种疾病的重要成分,也可用作肥料。氨基甲酸铵是一种白色固体,易分解、易水解,难溶于CCl4。实验小组设计在实验室中用氨气和二氧化碳反应制备氨基甲酸铵。
(1)氨气的制备
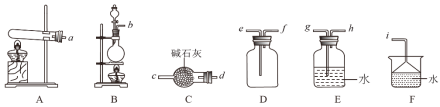
①实验室制取氨气的发生装置可以选择图中的__,反应的化学方程式为__。
②欲收集一瓶干燥的氨气,选择图中的装置,其连接顺序为:发生装置→__。(按气流方向,用小写字母表示)。
(2)氨基甲酸铵(NH2COONH4)的制备把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。制备氨基甲酸铵的装置和反应的化学方程式如下:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H<0。
NH2COONH4(s) △H<0。
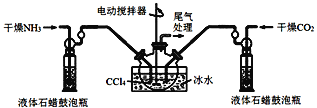
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的目的是___。
②液体石蜡鼓泡瓶的作用是__。
③从反应后的混合物中分离出产品的方法是__(填写操作名称)。
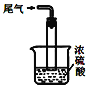
④尾气处理装置如图所示,装置中的浓硫酸的作用除了用于阻止空气中水蒸气进入反应器使氨基甲酸铵水解,还用于__。
⑤取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000 g。则样品中氨基甲酸铵的物质的量分数为__。(精确到2位小数,碳酸氢铵和氨基甲酸铵的相对分子质量分别为79和78)
【答案】A Ca(OH) 2 +2NH4Cl![]() CaCl2+2NH3↑+2H2O d→c→f→e→i(或d、c→f、e→i) 降低温度,防止因反应放热造成产物分解 通过观察气泡,调节NH3与CO2通入比例,控制气体流速 过滤 吸收多余氨气 80.00%
CaCl2+2NH3↑+2H2O d→c→f→e→i(或d、c→f、e→i) 降低温度,防止因反应放热造成产物分解 通过观察气泡,调节NH3与CO2通入比例,控制气体流速 过滤 吸收多余氨气 80.00%
【解析】
(1)①铵盐与碱加热制备氨气,为固体加热制备气体,浓氨水滴入固体氧化钙溶解放热促进一水合氨分解生成氨气,为固体和液态不加热制备气体的方法;
②生成氨气后,先干燥除去水,再选向下排空法收集,最后尾气处理需要防止倒吸;
(2)制备氨基甲酸铵的装置如图1所示,干燥的氨气通入液体石蜡鼓泡瓶,干燥的二氧化碳通过液体石蜡鼓泡瓶,氨气和二氧化碳进入三颈瓶冰水浴中搅拌反应,反应的化学方程式如下:2NH3(g)+CO2(g)NH2COONH4(s)△H<0。
(1)①实验室用加热固体氯化铵和氢氧化钙的方法制备氨气,反应物状态为固体与固体,反应条件为加热,所以选择A为发生装置,反应方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O,故答案为:A;Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O,故答案为:A;Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
②实验室用加热固体氯化铵和氢氧化钙的方法制备氨气,制备的气体中含有水蒸气,氨气为碱性气体,应选择盛有碱石灰干燥管干燥气体,氨气极易溶于水,密度小于空气密度所以应选择向下排空气法收集气体,氨气极易溶于水,尾气可以用水吸收,注意防止倒吸的发生,所以正确的连接顺序为:发生装置→d→c→f→e→i,故答案为: d→c→f→e→i(或d、c→f、e→i);
(2)①反应2NH3(g)+CO2(g)NH2COONH4(s)+Q,是放热反应,降温平衡正向进行,温度升高;发生器用冰水冷却提高反应物质转化率,防止生成物温度过高分解,故答案为:降低温度,防止因反应放热造成产物分解;
②液体石蜡鼓泡瓶的作用是控制反应进行程度,控制气体流速和原料气体的配比,故答案为:通过观察气泡,调节NH3与CO2通入比例,控制气体流速;
③制备氨基甲酸铵的装置如图3所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中,分离产品的实验方法利用过滤得到,故答案:过滤;
④浓硫酸起到吸收多余的氨气,同时防止空气中水蒸气进入反应器使氨基甲酸铵水解,故答案为:吸收多余氨气;
⑤取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.物质的量为0.010mol,设样品中氨基甲酸铵物质的量为x,碳酸氢铵物质的量为y,依据碳元素守恒得到;x+y=0.01 78x+79y=0.7820解得x=0.008moly=0.002mol则样品中氨基甲酸铵的物质的量分数=![]() ×100%=80%,故答案为:80.00%。
×100%=80%,故答案为:80.00%。