题目内容
【题目】1000mL某待测液中除含有0.2molL﹣1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl﹣、Br﹣、CO32﹣、HCO3﹣、SO32﹣、SO42﹣ |
现进行如下实验操作(所加试剂均过量):
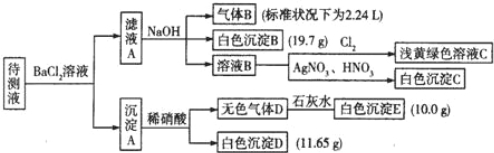
(1)写出生成白色沉淀B的离子方程式: 。
(2)若无色气体D是单一气体:
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
阴离子 | Cl﹣ | Br﹣ | CO32﹣ | HCO3﹣ | SO32﹣ | SO42﹣ |
浓度/molL﹣1 |
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由: 。
(3)若无色气体D是混合气体,待测液中一定含有的阴离子是 。
【答案】(1)HCO3﹣+Ba2++OH﹣=BaCO3↓+H2O (2)①
阴离子 | Cl﹣ | Br﹣ | CO32﹣ | HCO3﹣ | SO32﹣ |
浓度/molL﹣1 | ? | 0 | 0.1 | 0.1 | 0 |
②存在;K+离子最小浓度为0.1mol/L;(3)CO32﹣、HCO3﹣、SO32﹣
【解析】
试题分析:根据流程图可知,加入氯化钡溶液后产生白色沉淀,向沉淀A中加入稀硝酸,部分沉淀不溶解,说明一定含有硫酸钡,则沉淀A中硫酸根离子的物质的量是11.65g÷233g/mol=0.05mol;若沉淀A中含有亚硫酸钡,则可被硝酸氧化为硫酸钡,所以不能说明原溶液中含有SO42-;沉淀部分溶解,产生的气体能使澄清石灰水变浑浊,则沉淀A中一定含有碳酸钡;说明原溶液中含有CO32-;碳酸钙沉淀的质量是10.0g,说明碳酸根离子的物质的量是10.0g÷100g/mol=0.1mol;则原溶液中一定不存在Fe3+、Ba2+;滤液A中加入氢氧化钠溶液,产生气体B,说明溶液A中含有铵根离子,则原溶液中含有铵根离子,其物质的量是2.24L÷22.4L/mol=0.1mol;滤液A还能与氢氧化钠溶液反应生成沉淀B,则该沉淀为碳酸钡沉淀,说明原溶液中一定存在HCO3-,其物质的量是19.7g÷197g/mol=0.1mol,说明原溶液中含有HCO3-的物质的量是0.1mol;向溶液B中通入氯气,得到浅黄绿色溶液,说明原溶液中不含溴离子;向溶液B中加入硝酸和硝酸银,产生白色沉淀为AgCl,但开始加入的氯化钡溶液中含有氯离子,所以不能判断原溶液中是否存在氯离子;
(1)溶液A中含有钡离子,加入过量的氢氧化钠溶液后,则氢氧根离子与碳酸氢根离子反应生成碳酸根离子和水,碳酸根离子与钡离子反应生成碳酸钡沉淀,离子方程式是HCO3﹣+Ba2++OH﹣=BaCO3↓+H2O;
(2)①若无色气体D是单一气体,说明沉淀A中不含亚硫酸钡,则溶液中不含亚硫酸根离子,所以一定含有硫酸根离子,其物质的量是0.05mol,根据以上分析可知,一定不存在的阴离子是溴离子、亚硫酸根离子;一定存在的阴离子是碳酸根离子、硫酸根离子、碳酸氢根离子,其物质的量分别是0.1mol、0.05mol、0.1mol;溶液的体积为1L,则离子的物质的量难点可以计算,其中氯离子不能确定;
②溶液中一定存在的阳离子是钠离子和铵根离子,根据电荷守恒,一定存在的阴离子的电荷总物质的量浓度为0.1×2+0.05×2+0.1=0.4mol/L,而钠离子与铵根离子的物质的量浓度之和为0.2mol+0.1mol=0.3mol/L<0.4mol/L,所以一定存在钾离子;因为氯离子不能确定,则钾离子的物质的量浓度≥(0.1×2+0.05×2+0.1-0.2-0.1)mol/L=0.1mol/L;
(3)若无色气体D是混合气体,则沉淀A中一定含有亚硫酸钡,所以待测液中一定含有的阴离子是CO32-、HCO3-、SO32-。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案