题目内容
【题目】硫代硫酸钠(Na2S2O3·5H2O),俗称大苏打,是无色透明晶体,易溶于水,易被氧化。是一种重要的化工产品,临床上用于氰化物的解毒剂,工业上也用于纸浆漂白的脱氯剂。某兴趣小组在实验室用如下装置(夹持仪器略去)模拟硫代硫酸钠生产过程。
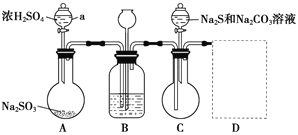
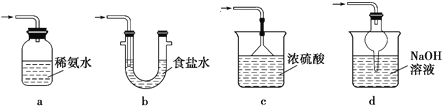
(1)仪器a的名称为_________。
(2)装置A中发生反应的化学方程式为_____________________________。
(3)为提高产品纯度,应使烧瓶C中Na2S和Na2CO3恰好完全反应,则烧瓶C中Na2S和Na2CO3物质的量之比为____________。
(4)装置B中盛有饱和NaHSO3溶液,装置B的作用是_________、__________。
(5)装置D用于处理尾气,可选用的最合理装置(夹持仪器已略去)为____(填序号)。
(6)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
已知:Na2S2O3稀溶液与BaCl2溶液混合无沉淀生成。
限选试剂:稀HNO3、稀H2SO4、稀HCl、蒸馏水
【答案】 分液漏斗 Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O[或Na2SO3+2H2SO4(浓)===2NaHSO4+SO2↑+H2O] 2:1 通过观察气泡速率控制滴加硫酸的速度 安全瓶 d 过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀HCl
【解析】(1)根据仪器图写出名称;(2)A中反应Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O ;装置B为安全装置,可防止倒吸,装置D用来吸收含有SO2的尾气,可以盛NaOH溶液;当B中导气管堵塞时,B内压强增大,锥形瓶中的液面下降,漏斗中的液面上升. (3)烧瓶C中,该转化过程的总反应:2Na2S+ Na2CO3+4 SO2=3 Na2S2O3+CO2,则C瓶中Na2S和Na2CO3的物质的量之比最好为2:1.(4) 装置B中盛有饱和NaHSO3溶液,装置B的作用是通过观察气泡速率控制滴加硫酸的速度同时起到安全瓶作用;(5)防倒吸可选d装置;(6)为检验产品中是否含有Na2SO4和Na2SO3取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,加入足量稀HCl,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
结合以上分析,(1) (1)仪器a的名称为分液漏斗;
(2)装置A中发生反应的化学方程式为Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。
(3)烧瓶C中,该转化过程的总反应:2Na2S+ Na2CO3+4 SO2=3 Na2S2O3+CO2,则C瓶中Na2S和Na2CO3的物质的量之比最好为2:1,因此,本题答案为:2:1。
(4)从仪器连接可知,装置B中盛有饱和NaHSO3溶液,由于二氧化硫不溶于饱和NaHSO3溶液,故其作用是通过观察气泡速率控制滴加硫酸的速度同时起到安全瓶作用防堵塞,原理是,若B中导气管堵塞时,B内压强增大,锥形瓶中的液面下降,漏斗中的液面上升。因此,本题答案为:通过观察气泡速率控制滴加硫酸的速度 ; 安全瓶;
(5)装置D用于处理尾气,要能吸收SO2同时防倒吸,应选d。
(6) 亚硫酸钡溶于盐酸,硫酸钡不溶于盐酸,为检验产品中是否含有Na2SO4和Na2SO3取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,加入足量稀HCl,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。