题目内容
在101 kPa时,燃烧1 t含FeS2质量分数为70%的黄铁矿生成固态Fe2O3和气态SO2),放出4.98×106 kJ的热量。表示上述反应的热化学方程式正确的是( )A.FeS2(s)+![]() O2 (g)====
O2 (g)====![]() Fe2O3(s)+2SO2 (g);ΔH=-853.7kJ/mol
Fe2O3(s)+2SO2 (g);ΔH=-853.7kJ/mol
B.4FeS2(s)+11O2 (g)====2Fe2O3(s)+8SO2 (g);ΔH=+853.7 kJ/mol
C.4FeS2(s)+11O2 (g)====2Fe2O3(s)+8SO2 (g);ΔH=+3 414.8 kJ/mol
D.FeS2(s)+![]() O2 (g)====
O2 (g)====![]() Fe2O3(s)+2SO2 (g);ΔH=-3 414.8 kJ/mol
Fe2O3(s)+2SO2 (g);ΔH=-3 414.8 kJ/mol
A
【解析】本题主要考查计算能力,通过计算,1 mol FeS2燃烧时放出的热量为
ΔH=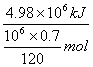 =853.7kJ/mol,该反应放热,所以ΔH=-853.7 kJ/mol。
=853.7kJ/mol,该反应放热,所以ΔH=-853.7 kJ/mol。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

