题目内容
17.医学上在进行胃肠疾病的检查时,利用X射线对BaSO4穿透能力较差的特性,常用BaSO4做内服造影剂,这种检查手段称为钡餐透视.Ⅰ.请写出BaSO4能作为钡餐透视的另外一个理由:BaSO4既不溶于水,也不溶于酸,可经人体排出体外,不会引起Ba2+中毒.
Ⅱ.请用文字叙述和离子方程式说明钡餐透视时为什么不用BaCO3?BaCO3遇到胃酸发生反应:BaCO3+2H+=Ba2++H2O+CO2↑,生成的Ba2+会使人中毒.
Ⅲ.某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:
①5mL水
②20mL 0.5mol•L-1的Na2SO4溶液
③40mL 0.2mol•L-1的Ba(OH)2溶液
④40mL 0.1mol•L-1的H2SO4溶液中,溶解至饱和.
(1)以上各溶液中,c(Ba2+)的大小顺序正确的是A,BaSO4的溶解度的大小顺序为C(填序号).
A.③>①>④>②B.③>①>②>④
C.①>④>③>②D.①>③>④>②
(2)已知25℃时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液③中的c(SO${\;}_{4}^{2-}$)为5.5×10-10mol/L,溶液②中c(Ba2+)为2.2×10-10mol/L.
(3)某同学取同样的溶液③和溶液④直接混合,则混合溶液的pH为13(假设混合后溶液的体积为混合前两溶液的体积之和).
分析 Ⅰ.BaSO4既不溶于水,也不溶于酸,不会引起Ba2+中毒;
Ⅱ.BaCO3遇到胃酸生成氯化钡、二氧化碳与水,Ba2+会使人中毒;
Ⅲ.(1)含有相同的离子能抑制硫酸钡的溶解,硫酸根离子或钡离子浓度越大,硫酸钡的溶解度越小,氢氧化钡溶液中含有钡离子浓度最大;
(2)溶液③中钡离子抑制硫酸钡溶解,溶解硫酸钡后溶液中c(Ba2+)≈0.2mol/L,溶液中②中硫酸根抑制钡离子溶解,溶解硫酸钡后溶液中c(SO4 2-)≈0.5mol/L,再根据Ksp(BaSO4)=c(Ba2+)×c(SO4 2-)=1.1×10-10计算;
(3)混合后反应后氢氧化钡有剩余,溶液呈碱性,计算混合溶液中氢氧根离子浓度,再根据水的离子积计算氢离子浓度,再根据pH=-lgc(H+)计算.
解答 解:Ⅰ.BaSO4既不溶于水,也不溶于酸,可经人体排出体外,不会引起Ba2+中毒,故BaSO4能作为钡餐透视;
故答案为:BaSO4既不溶于水,也不溶于酸,可经人体排出体外,不会引起Ba2+中毒;
Ⅱ.BaCO3遇到胃酸生成氯化钡、二氧化碳与水,反应离子方程式为:BaCO3+2H+=Ba2++H2O+CO2↑,生成的Ba2+会使人中毒,
故答案为:BaCO3遇到胃酸发生反应:BaCO3+2H+=Ba2++H2O+CO2↑,生成的Ba2+会使人中毒;
Ⅲ.(1)硫酸钡难溶于水,氢氧化钡溶液中含有钡离子浓度最大,溶液中硫酸根离子会抑制硫酸钡溶解,故硫酸钠溶液、H2SO4溶液中溶解的硫酸钡小于在水中的溶解度,水中钡离子浓度次之,硫酸钠中的硫酸根浓度大于硫酸中的浓度,故溶解硫酸钡后硫酸钠溶液中钡离子的浓度小于硫酸溶液中钡离子浓度,所以钡离子浓度大小顺序是:③>①>④>②;
钡离子、硫酸根抑制硫酸钡溶液,故水中溶解度最大,钡离子、硫酸根浓度越大,硫酸钡溶解度越小,故BaSO4的溶解度的大小顺序为:①>④>③>②,
故答案为:A;C;
(2)溶液③中钡离子抑制硫酸钡溶解,溶解硫酸钡后溶液中c(Ba2+)≈0.2mol/L,故溶液中c(SO4 2-)=$\frac{1.1×1{0}^{-10}}{0.2}$mol/L=5.5×10-10mol/L,
溶液中②中硫酸根抑制钡离子溶解,溶解硫酸钡后溶液中c(SO4 2-)≈0.5mol/L,故溶液中c(Ba2+)=$\frac{1.1×1{0}^{-10}}{0.5}$mol/L=2.2×10-10mol/L,
故答案为:5.5×10-10mol/L,2.2×10-10mol/L;
(3)混合后反应后氢氧化钡有剩余,溶液呈碱性,混合后溶液中c(OH-)=$\frac{(0.2-0.1)mol/L×2×0.04L}{0.04L×2}$=0.1mol/L,则c(H+)=10-13 mol/L,所以pH=-lg10-13=13,
故答案为:13.
点评 本题考查难溶电解质溶解平衡、溶度积有关计算、溶液pH计算、元素化合物性质等,(2)中注意溶液中离子估算,需要学生具备扎实的基础与灵活运用能力.

| A. | Ag+物质的量浓度 | B. | NO3-物质的量浓度 | ||
| C. | 溶液的pH | D. | 银棒的质量 |
| A. | MnO2、CuO、Fe三种物质的粉末都是黑色的,用稀盐酸不能将它们区别开 | |
| B. | (NH4)2SO4、K2SO4、NH4Cl三种溶液可以用加入NaOH溶液并加热的方法区分开 | |
| C. | 除去KNO3中的少量NaCl,可将混合物制成热的饱和溶液,冷却结晶,过滤 | |
| D. | 用湿润的KI淀粉试纸可以检验溴蒸气中是否含有NO2 |
| A. | NaAlO2(aq)→Al2O3→Al(OH)3 | B. | N2→NO2→HNO3 | ||
| C. | Na→Na2O2→Na2CO3 | D. | S→SO3→H2SO4 |
 (1)元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”.
(1)元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”. .
.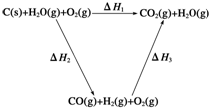 已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);
已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);