题目内容
【题目】Ⅰ、下图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前后盛放盐酸的滴定管中液面的位置。

实验编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的读数(mL) | 滴定后盐酸的读数(mL) |
1 | 20.00 | 1.20 | 23.22 |
2 | 20.00 | 1.21 | 29.21 |
3 | 20.00 | 1.50 | 23.48 |
请回答下列问题:
(1)仪器A的名称是_________________。
(2)盐酸的体积读数:滴定前读数为___________,滴定后读数为_____________。
(3)某实验小组同学的三次实验的实验数据如上表所示。根据表中数据计算出待测NaOH溶液的平均溶度是____________mol/L(保留四位有效数字)。
(4)对下列几种假定情况进行讨论:
①取待测溶液的滴定管,放液前滴定管尖端有气泡,放液后气泡消失,对测定结果的影响是____________(填“无影响”“偏高”或“偏低”,下同)
②滴定前锥形瓶未用待测液润洗,对测定结果的影响是_______________;
Ⅱ、氧化还原滴定实验与酸碱中和滴定类似,原理是用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之。现用0.001mol/L酸性KMnO4溶液滴定位置浓度的Na2SO3溶液,反应的离子方程式是2MnO4- + 5SO32- + 6H+=2Mn2+ + 5SO42- + 3H2O。请回答下列问题:
(1)该滴定实验所需仪器有________________。
A、酸式滴定管(50mL) B、碱式滴定管(50mL) C、量筒(10mL) D、锥形瓶 E、铁架台F、滴定管夹 G、烧杯 H、胶头滴管 I、漏斗
(2)实验时,应用_____________(填“酸式”或“碱式”,下同)滴定管盛放高锰酸钾溶液,应用__________滴定管盛放亚硫酸钠溶液。
(3)该实验_____________(填“需要”或“不需要”)加入指示剂,原因是_____________。滴定达到终点的标志是__________________。
【答案】酸式滴定管 0.80mL 22.80mL 0.1100molL-1 偏低 无影响 ABDEF 酸式滴定管 碱式滴定管 不需要 MnO4-为紫色,Mn2+为无色,可用这一明显的颜色变化来判断滴定终点 当最后一滴酸性KMnO4溶液滴入时,溶液由无色变为紫红色,且半分钟内不褪色
【解析】
Ⅰ、(1)根据仪器的构造分析;
(2)根据滴定管中的液面读数;
(3)根据c(待测)=![]() 计算;
计算;
(4)根据c(待测)=![]() 分析;
分析;
Ⅱ、(1)因为氧化还原滴定实验类似于中和滴定,由中和滴定实验所需仪器的选用进行迁移可得出正确答案;
(2)由于KMnO4具有强氧化性,亚硫酸钠水解呈碱性;
(3)原因是MnO4-为紫色,Mn2+为无色,可用这一明显的颜色变化来判断滴定终点。
Ⅰ、(1)该滴定管的下端是玻璃活塞,所以仪器的名称为酸式滴定管;
(2)滴定前,滴定管中的液面读数为0.80mL,滴定后,滴定管中的液面读数为22.80mL;
(3)三次滴定消耗的体积为:22.02mL,28.00mL,21.98mL,第二组数据误差太大,舍去,则平均消耗V(NaOH)=22.00mL,c(待测)=![]() =
=![]() =0.1100molL-1;
=0.1100molL-1;
(4)①取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失,待测液的物质的量偏小,导致标准液的体积偏小,根据c(待测)=![]() 分析,c(待测)偏低;
分析,c(待测)偏低;
②若滴定前锥形瓶未用待测液润洗,待测液的物质的量不变,标准液的体积也不变,根据c(待测)=![]() 分析,c(待测)不变;故答案为无影响;
分析,c(待测)不变;故答案为无影响;
Ⅱ、(1)用0.001mol/L酸性KMnO4溶液滴定末知浓度的Na2SO3溶液,实验所需仪器有酸式滴定管(50mL)、碱式滴定管(50mL)、锥形瓶、铁架台、滴定管夹;答案选ABDEF;
(2)由于KMnO4具有强氧化性,能腐蚀橡胶管,装在酸式滴定管中;亚硫酸钠水解呈碱性,装在碱式滴定管;
(3)该实验不需要加入指示剂,原因是MnO4-为紫色,Mn2+为无色,可用这一明显的颜色变化来判断滴定终点;滴定达到终点的标志是当最后一滴酸性KMnO4溶液滴入时,溶液由无色变为紫红色,且半分钟内不褪色。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
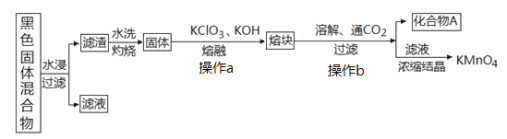
小学生10分钟应用题系列答案【题目】下图表示从废旧普通锌锰电池内容物中回收制备KMnO4等物质的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
(1)KMnO4稀溶液是一种常用消毒剂,其消毒机理与下列物质相似的是______________(填序号)
A.双氧水B.75%酒精C.84消毒液(NaClO溶液)D.苯酚
(2)①黑色固体混合物水浸时为提高浸出速率,常采用的措施为_____________________(答出一条即可)。
②滤渣水洗灼烧后固体是一种黑色的化合物,操作a中得到熔块的主要成分是K2MnO4和KCl,该过程中发生反应的化学方程式为:_____________________________。
③图中产物A是一种难溶于水的黑色固体,常在有些反应中作催化剂,其化学式为:_________________。
(3)某实验小组用提纯后的KMnO4配置成0.1000mol/L溶液来测定某试样中过氧化氢的含量
①查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:_____。
②配制250mL0.100mol/L标准KMnO4溶液,需要使用的玻璃仪器有烧杯、胶头滴管、量筒和、___________;
③滴定反应原理为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,该反应中H2O2体现___________(填“氧化性”、“还原性”、“酸性”);
④用0.100mol/L标准KMnO4溶液滴定含H2O2试样的溶液时,KMnO4溶液(酸化)放在_____滴定管中,并判断滴定至终点的现象是_____。
⑤用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的高锰酸钾体积如表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为___________mol/L。
⑥下列操作会引起测定结果偏高的是___________。
A.滴定管在盛装高锰酸钾前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.锥形瓶未用待测液润洗
【题目】25℃时,电离平衡常数如下表,下列说法错误的是
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
A.离子结合质子的能力由大到小的顺序是:CO32- > ClO- > HCO3- > CH3COO-
B.2ClO-+CO2+H2O=CO32-+2HClO反应不能发生
C.用蒸馏水稀释0.10mol·L-1的醋酸,c(CH3COO-)/c(CH3COOH)的数值逐渐增大
D.等体积、等pH的CH3COOH与HClO两溶液与NaOH恰好完全反应,CH3COOH消耗氢氧化钠物质的量更多


