题目内容
氮是地球上含量丰富的一种元素,氮及其化合物在工 农业生产、生活中有着重要作用,

(1)上图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式: 。
(2)若已知下列数据:
试根据表中及图中数据计算N-H的键能 kJ·mol-1。
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1 ,E2______,
△H (填“增大”、“减小”、“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如
4NH3(g)+3O2(g)= 2N2(g)+6H2O(g) ;△H1=akJ·mol-1
N2(g)+O2(g)=2NO(g); △H2=bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3= kJ/mol(用含a、b的式子表示)。

(1)上图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式: 。
(2)若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能 kJ·mol-1。
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1 ,E2______,
△H (填“增大”、“减小”、“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如
4NH3(g)+3O2(g)= 2N2(g)+6H2O(g) ;△H1=akJ·mol-1
N2(g)+O2(g)=2NO(g); △H2=bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3= kJ/mol(用含a、b的式子表示)。
(1)N2(g)+2H2(g) 2NH3(g)△H=-92kJ/mol
2NH3(g)△H=-92kJ/mol
(2) 390 (3) 减小 减小 不变 (4)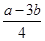
 2NH3(g)△H=-92kJ/mol
2NH3(g)△H=-92kJ/mol(2) 390 (3) 减小 减小 不变 (4)
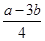
试题分析:(1)根据图像可知,反应物总能量大于生成物总能量,应为放热反应,生成1mol氨气放出300kJ-254kJ=46kJ热量,则反应的热化学方程式为N2(g)+2H2(g)
 2NH3(g)△H=-92kJ/mol。
2NH3(g)△H=-92kJ/mol。(2)反应热等于反应物的总键能减去生成物的总键能,设N-H的键能为x,则943+3×435-6x=-92,解得x=390,故N-H的键能为390kJ。
(3)加入催化剂,反应物和生成物的活化能都降低,故答案为:减小;减小;但催化剂不能影响反应热,所以该反应的△H不变。
(4)已知①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H1=akJ/mol、②N2(g)+O2(g)=2NO(g)△H2=bkJ/mol,利用盖斯定律将(①-3×②)÷4即得到反应NH3(g)+
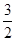 NO(g)=
NO(g)=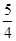 N2(g)+
N2(g)+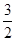 H2O(g),所以该反应的反应热△H3=
H2O(g),所以该反应的反应热△H3=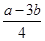 kJ/mol。
kJ/mol。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目