题目内容
【题目】根据反应2KMnO4+16HCl(浓)=2KCl+2MnC12+5Cl2↑+8H2O填写下列各空:
(l)____________元素被还原,____________是还原剂;
(2)氧化产物与还原产物的物质的量之比为____________;
(3)用双线桥标明上述化学方程式的电子转移的方向和数目:_____________
2KMnO4+16HCl(浓)=2KCl+2MnC12+5Cl2↑+8H2O
【答案】 Mn HCl 5:2 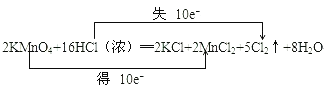
【解析】(1)在2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O中,Mn元素的化合价降低被还原,氯元素的化合价升高被氧化,还原剂为HCl;
(2)在2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O中,Cl元素的化合价升高,对应氧化产物为Cl2,Mn元素化合价降低,对应的还原产物为MnCl2,氧化产物与还原产物的物质的量之比为5:2 ;
(3)根据反应中元素化合价的变化,并结合电子守恒,用双线桥分析此反应为: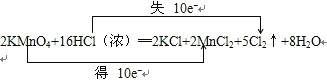 。
。

练习册系列答案
相关题目