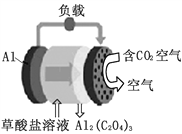
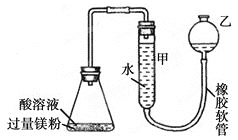
题目内容
【题目】稀土是一种重要的战略资源。氟碳铈矿主要化学成分为CeFCO3,它是提取铈等稀土元素的重要矿物原料。氟碳铈矿的冶炼工艺流程如下:
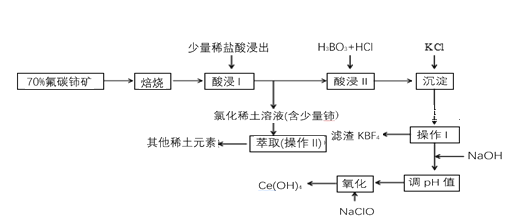
已知:i.铈的常见化合价为+3、+4。焙烧后铈元素转化成CeO2和CeF4。四价铈不易进入溶液,而三价稀土元素易进入溶液。
ii.酸浸II中发生反应:9CeO2+3CeF4+45HCl+3H3BO3=Ce(BF4)3↓+11CeCl3+6Cl2↑+27H2O
请回答下列问题:
(1)①焙烧氟碳铈矿的目的是_______。
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________。
CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________。
(2)在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。少量铈进入稀土溶液发生反应的离子方程式是________。
(3)向Ce(BF4)3中加入KCl溶液的目的是______。
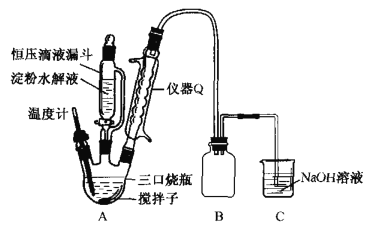
(4)操作I的名称为_______,在实验室中进行操作II时所需要的硅酸盐仪器有_______。
(5)“操作I”后,向溶液中加入NaOH溶液来调节溶液的pH,以获得Ce(OH)3沉淀,常温下加入NaOH调节溶液的pH应大于________即可认为Ce3+已完全沉淀。(已知:Ksp[Ce(OH)3]=1.0×10-20)
(6)取上述流程中得到的Ce(OH)4产品5.000g,加酸溶解后,向其中加入含0.03300mol FeSO4的FeSO4溶液使Ce4+全部被还原成Ce3+,再用0.1000mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00mL标准溶液。则该产品中Ce(OH)4的质量分数为______(已知氧化性:Ce4+>KMnO4;Ce(OH)4的相对分子质量为208,保留3位有效数字)。
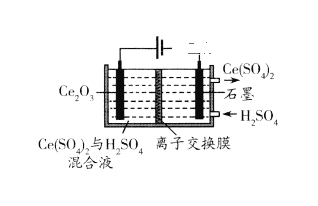
(7)在酸性条件下电解Ce2O3制备Ce(SO4)2(如下图),阳极电极反应式_______。
【答案】将铈氧化为四价便于与其他稀土元素分离 2xCO+CeO2=CeO2(1-x)+2xCO2 8H++2Cl-+2CeO2=2Ce3++Cl2↑+4H2O 避免Ce3+以Ce(BF4)3形式沉淀而损失(或将Ce3+全部转化为CeCl3,提高产率) 过滤 烧杯、分液漏斗 9 95.7% Ce2O3 +6H+ -2e- = 2Ce4++3H2O
【解析】
根据题意可知,本题考查氟碳铈矿的冶炼工艺流程,运用氧化还原反应化合价变化规律、离子方程式书写步骤、除杂步骤方法分析。
(1)①通过焙烧氟碳铈矿,可将铈氧化为四价,便于与其他稀土元素分离,
故答案为:将铈氧化为四价便于与其他稀土元素分离;
②尾气消除过程中发生着CeO2CeO2(1x)+xO2↑(0≤x≤0.25)的循环,可知CeO2具有氧化性,可氧化CO生成CO2,则CeO2消除CO尾气的化学方程式为2xCO+CeO2=CeO2(1x)+2xCO2,
故答案为:2xCO+CeO2=CeO2(1x)+2xCO2;
(2)在酸浸I中用盐酸溶解CeO2,有少量铈进入滤液,可知有Ce3+生成,且产生黄绿色气体,此气体为Cl2,则此时发生反应的离子方程式是8H++2Cl-+2CeO2=2Ce3++Cl2↑+4H2O,
故答案为:8H++2Cl-+2CeO2=2Ce3++Cl2↑+4H2O;
(3)向Ce(BF4)3中加入KCl溶液生成CeCl3和KBF,这样做的目的是避免三价铈以Ce(BF4)3沉淀的形式损失或除去BF4或提高CeCl3的产率,
故答案为:避免Ce3+以Ce(BF4)3形式沉淀而损失(或将Ce3+全部转化为CeCl3,提高产率);
(4)操作I为固液分离,应选择过滤操作;操作II为萃取,则所需要的硅酸盐仪器有分液漏斗、烧杯,
故答案为:过滤;分液漏斗、烧杯;
(5)溶液中的c(Ce3+)等于1×105molL1,可认为Ce3+沉淀完全,根据KSP[Ce(OH)3]=c(Ce3+)c3(OH)=1×1020可知,![]() ,此时溶液的PH为9,即加入NaOH 调节溶液的pH 应大于9,即可认为Ce3+已完全沉淀,
,此时溶液的PH为9,即加入NaOH 调节溶液的pH 应大于9,即可认为Ce3+已完全沉淀,
故答案为:9;
(6)用0.1000molL1的酸性KMnO4标准溶液滴定至终点时,消耗20.00mL标准溶液,主要是氧化溶液中剩余的Fe2+,根据电子守恒剩余Fe2+的物质的量为![]() ,则还原Ce4+消耗的Fe2+的物质的量为0.03300mol0.01mol=0.02300mol,根据Ce4++Fe2+=Fe3++Ce3+,则Ce4+的物质的量为0.02300mol,该产品中Ce(OH)4的质量分数为
,则还原Ce4+消耗的Fe2+的物质的量为0.03300mol0.01mol=0.02300mol,根据Ce4++Fe2+=Fe3++Ce3+,则Ce4+的物质的量为0.02300mol,该产品中Ce(OH)4的质量分数为![]() ,
,
故答案为:95.7;
(7)在酸性条件下电解Ce2O3制备Ce(SO4)2,阳极是Ce2O3发生氧化反应变为Ce(SO4)2,因此阳极电极反应式Ce2O3 +6H+ -2e- = 2Ce4++3H2O,
故答案为:Ce2O3 +6H+ -2e- = 2Ce4++3H2O。

 学习实践园地系列答案
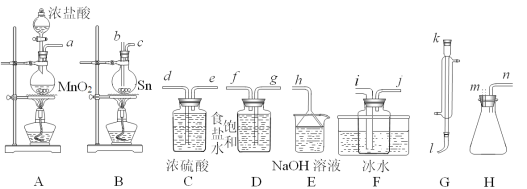
学习实践园地系列答案【题目】四氯化锡(SnCl4)常作有机合成的催化剂,在空气中极易水解生成SnO2·xH2O,实验室用熔融的锡(熔点为231.9℃)与氯气反应来制备(同时有SnCl2生成),该反应是放热反应。可选用的仪器及装置如图所示。
SnCl2、SnCl4有关物理性质如表:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 623 |
SnCl4 | 无色液体 | -33 | 114 |
(1)已知SnCl2、SnCl4晶体类型相同,SnCl2熔沸点高于SnCl4的原因是:___。
(2)选择装置进行连接(填各接口的字母,装置可重复使用,空格可不填满)。___
a→__,__→__,__→__,__→__,__→__,__→__,__→__,__→__。
(3)反应开始时,应先点燃装置___(填“A”或“B”,下同)的酒精灯,待___时,再点然装置___的酒精灯,并在反应进行中仍持续加热,其目的是___。
(4)该方法制得的SnCl4中含有少量SnCl2,提纯SnCl4的实验名称是___。
(5)测定产品纯度。取ag产品溶于少量浓盐酸,加入蒸馏水稀释至250mL。取20mL稀释溶液于锥形瓶,滴加几滴淀粉溶液,用cmol·L-1I2溶液滴定至终点,消耗滴定溶液V mL。
①该产品中SnCl2含量为___%。(滴定反应:Sn2++I2=Sn4++2I-,SnCl2的相对分子质量为:190)
②若操作时间过长、振荡剧烈,测得产品中SnCl4含量__(填“偏高”或“偏低”或“无影响”)。
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。反应Ⅰ:CO(g)+2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
温度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.0 | 0.27 | 0.012 |
(1)由表中数据判断ΔH1________(填“>”、“<”或“=”)0;反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH3=___________(用ΔH1和ΔH2表示)。
CO(g)+H2O(g) ΔH3=___________(用ΔH1和ΔH2表示)。
(2)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是________(填字母序号)
A.充入CO,使体系总压强增大 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.使用高效催化剂
(3)保持恒温恒容条件对于反应Ⅱ:将10 mol CO2和30mol H2放入1 L的密闭容器中,充分反应后测得CO2的转化率为60%,则该反应的平衡常数为____________________。若维持条件不变向该容器中投入10 mol CO2、30mol H2、10 mol CH3OH(g)和 10mol H2O(g),判断平衡移动的方向是________(填“正向移动”、“逆向移动”或“不移动”)。
(4)反应Ⅰ的逆反应速率与时间的关系如图所示。由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:t2时_______________________;t8时______________________________。