题目内容
【题目】有A、B、C三种元素,已知A元素原子的K层和M层电子数相同;B元素原子的L层比K层电子数多5个;C元素的+3价阳离子和氖原子具有相同的电子数。
(1)写出A的元素符号___________________;元素C的一种原子(中子数为14)的原子符号_______________;
(2)B的阴离子结构示意图________;A、B组成的化合物的化学式__________ 。
【答案】Mg 2713Al 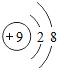 MgF2
MgF2
【解析】
元素原子的K层和M层电子数相同,说明原子核外有3个电子层,最外侧电子数为2,应为Mg,B元素原子的L层比K层电子数多5个,原子核外各层电子分别为2、7,应为F元素,C元素的+3价阳离子和氖原子具有相同的电子数,应为Al元素。
(1)A为镁元素,元素符号为Mg,元素C为Al,其质量数为27,核内有13个质子,则Al的原子核组成符号为2713Al,故答案为:Mg;2713Al;
(2)已知B为F元素,F的阴离子核外有10个电子,其离子结构示意图为: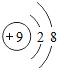 ,A、B组成的化合物的化学式为MgF2,故答案为:
,A、B组成的化合物的化学式为MgF2,故答案为: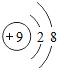 ;MgF2。
;MgF2。

 名校课堂系列答案
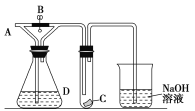
名校课堂系列答案【题目】某学生以酚酞为指示剂用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 27.45 |
第二次 | 25.00 | 0.00 | 30.30 |
第三次 | 25.00 | 0.00 | 27.55 |
下列说法正确的是:
A. 当溶液从无色刚好变成红色时,则滴定终点达到
B. 该氢氧化钠溶液中c(NaOH)=0.110 0 mol·L-1
C. .滴定达终点时,滴定管尖嘴有悬液,则测定结果偏低
D. 实验中锥形瓶应用待测氢氧化钠溶液润洗