题目内容
【题目】化合物I是一种药物合成中间体,与I相关的反应如下:
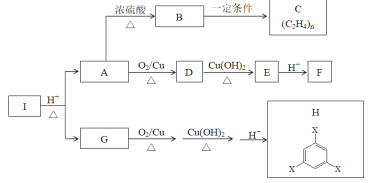
根据以上信息回答下列问题。
(1)B→C的反应类型是___________。
(2)写出D→E的化学方程式___________。
(3)下列说法正确的是____________
A.物质H中的官能团X为—COOH B.物质C是纯净物
C.有机物A和B以任意物质的量之比混合,只要混合物的总物质的量相同,那么混合物充分燃烧消耗的氧气的量相同
D.工业上用物质B与O2在催化剂条件下可生产环氧乙烷
(4)实验室取1.96g G完全燃烧,将燃烧产物通过碱石灰,碱石灰质量增加4.68g;若将燃烧产物通过浓硫酸,浓硫酸的质量增加0.72g。G的分子式是___________。
【答案】加聚反应 CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O ACD C9H8O5
CH3COONa+Cu2O↓+3H2O ACD C9H8O5
【解析】
C为聚乙烯,那么B为乙烯,B生成C的反应即加聚反应;由A依次生成D,E,F的条件可知,A中一定有羟基,所以A为乙醇;由G生成H的条件可知,G中一定含有羟基,H中一定含有羧基,所以H中的-X即为羧基;根据(4)中提供的燃烧的相关信息,可计算出G的分子式,结合前面推出的信息就可以确定G的结构中含有两个羧基,1个羟基。
(1)通过分析可知,B生成C即乙烯生成聚乙烯的反应,反应类型为加聚反应;
(2)D生成E的反应即乙醛与弱氧化剂Cu(OH)2反应的反应;方程式为:CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O;
CH3COONa+Cu2O↓+3H2O;
(3)A.通过分析可知,H中X的官能团为羧基,A项正确;
B. 物质C为聚乙烯,高分子有机化合物都是混合物,B项错误;
C.A为乙醇,1mol乙醇完全燃烧消耗3molO2;B为乙烯,1mol乙烯完全燃烧消耗也是3molO2,所以A与B无论何种比例混合,只要混合物的总物质的量相同,则完全燃烧消耗的氧气的量就相同,C项正确;
D.乙烯可以在银的催化下与O2反应生成环氧乙烷,工业上可以采用这种方法生产环氧乙烷,D项正确;
答案选ACD;
(4) 1.96gG中含有H0.08g即0.08mol,含有C1.08g即0.09mol,那么O的质量为0.8g即0.05mol,再结合推断流程分析可知,G分子式为C9H8O5。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案