题目内容
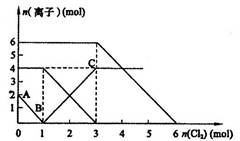
(7分)向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。
已知:2Fe2++Br2 2Fe3++2Br- 2Fe3++2I-
2Fe3++2Br- 2Fe3++2I- 2Fe2++I2
2Fe2++I2
(1)Fe2+、I-、Br-的还原性由强到弱排列顺序为 。
(2)当通入2mol Cl2时,溶液中已发生的离子反应可表示为: 。
(3)原混合溶液中FeBr2的物质的量为 。
(4)原溶液中:n(Fe2+):n(I-):n(Br-)= 。

已知:2Fe2++Br2
 2Fe3++2Br- 2Fe3++2I-
2Fe3++2Br- 2Fe3++2I- 2Fe2++I2
2Fe2++I2(1)Fe2+、I-、Br-的还原性由强到弱排列顺序为 。
(2)当通入2mol Cl2时,溶液中已发生的离子反应可表示为: 。
(3)原混合溶液中FeBr2的物质的量为 。
(4)原溶液中:n(Fe2+):n(I-):n(Br-)= 。
(7分)(1)I->Fe2+>Br-(2)2Fe2++2I-+2Cl2 2Fe3++I2+4Cl-
2Fe3++I2+4Cl-
(3)3mol (4)2:1:3
 2Fe3++I2+4Cl-
2Fe3++I2+4Cl-(3)3mol (4)2:1:3
(1)根据还原剂的还原性强于还原产物的还原性,由方程式2Fe2++Br2 2Fe3++2Br- 2Fe3++2I-
2Fe3++2Br- 2Fe3++2I- 2Fe2++I2可知,Fe2+、I-、Br-的还原性由强到弱排列顺序为I->Fe2+>Br-
2Fe2++I2可知,Fe2+、I-、Br-的还原性由强到弱排列顺序为I->Fe2+>Br-
(2)由图像可知,当通入的0mol<n(Cl2)<1mol时,发生反应:2Fe3++2I- 2Fe2++I2,I—的物质的量由2mol降至0mol,溶液中I-为2mol,FeI2为1mol;
2Fe2++I2,I—的物质的量由2mol降至0mol,溶液中I-为2mol,FeI2为1mol;
当通入的1mol<n(Cl2)<3mol时,发生反应:2Fe2++Cl2 2Fe3++2Cl-,Fe2+的物质的量由4mol降至0mol,溶液中FeBr2为4—1=3mol,Br-为6mol;
2Fe3++2Cl-,Fe2+的物质的量由4mol降至0mol,溶液中FeBr2为4—1=3mol,Br-为6mol;
进而可知,当通入的3mol<n(Cl2)<6mol时,发生反应:2Br-+Cl2 Br2+2Cl-
Br2+2Cl-
当通入2mol Cl2时,由电子的得失守恒可知,参加反应的I-为2mol,Fe2+为2mol,离子反应式为:2Fe2++2I-+2Cl2 2Fe3++I2+4Cl-
2Fe3++I2+4Cl-
(3)原混合溶液中FeBr2的物质的量为3mol
(4)原溶液中:n(Fe2+):n(I-):n(Br-)=4:2:6=2:1:3
 2Fe3++2Br- 2Fe3++2I-
2Fe3++2Br- 2Fe3++2I- 2Fe2++I2可知,Fe2+、I-、Br-的还原性由强到弱排列顺序为I->Fe2+>Br-
2Fe2++I2可知,Fe2+、I-、Br-的还原性由强到弱排列顺序为I->Fe2+>Br-(2)由图像可知,当通入的0mol<n(Cl2)<1mol时,发生反应:2Fe3++2I-
 2Fe2++I2,I—的物质的量由2mol降至0mol,溶液中I-为2mol,FeI2为1mol;
2Fe2++I2,I—的物质的量由2mol降至0mol,溶液中I-为2mol,FeI2为1mol;当通入的1mol<n(Cl2)<3mol时,发生反应:2Fe2++Cl2
 2Fe3++2Cl-,Fe2+的物质的量由4mol降至0mol,溶液中FeBr2为4—1=3mol,Br-为6mol;
2Fe3++2Cl-,Fe2+的物质的量由4mol降至0mol,溶液中FeBr2为4—1=3mol,Br-为6mol;进而可知,当通入的3mol<n(Cl2)<6mol时,发生反应:2Br-+Cl2
 Br2+2Cl-
Br2+2Cl-当通入2mol Cl2时,由电子的得失守恒可知,参加反应的I-为2mol,Fe2+为2mol,离子反应式为:2Fe2++2I-+2Cl2
 2Fe3++I2+4Cl-
2Fe3++I2+4Cl-(3)原混合溶液中FeBr2的物质的量为3mol
(4)原溶液中:n(Fe2+):n(I-):n(Br-)=4:2:6=2:1:3

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
 重要的地位,了解铁及其化合物的性质和用途非常重要。请回答下列问题:
重要的地位,了解铁及其化合物的性质和用途非常重要。请回答下列问题: 加入试液,滴入KSCN溶液,若显血红色,证明一定存在Fe3+。
加入试液,滴入KSCN溶液,若显血红色,证明一定存在Fe3+。
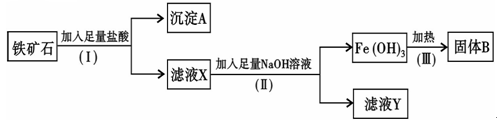
 (填化学式),固体B是 (填化学式);
(填化学式),固体B是 (填化学式);