题目内容
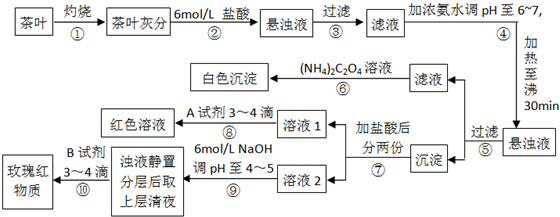
某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素.【已知完全沉淀的pH:Ca(OH)2:pH≥13;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1】
下列说法不正确的是( )

下列说法不正确的是( )
| A、步骤②加入6mol/L盐酸的主要目的是为了将茶叶灰分中的钙、铁、铝难溶性化合物转化为可溶性氯化物 | B、步骤⑤所得滤液中溶质的主要成分为:CaCl2、NH3?H2O | C、步骤⑥可以检出钙元素存在,离子反应方程式为Ca2++C2O42-═CaC2O4↓ | D、步骤⑧中A试剂为KSCN溶液,离子反应方程式为Fe3++3SCN-?Fe(SCN)3 |
分析:茶叶灼烧得到灰分是在坩埚中进行,步骤②加入6mol/L盐酸将金属离子转化为氯化物;步骤④在pH为6-7时加热30 min,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀,所以⑤过滤后所得滤液中含Ca2+,检验Ca2+的离子方程式为Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+;步骤⑥中发生反应是草酸铵和钙离子形成草酸钙沉淀的反应;⑧是加入硫氰酸钾溶液出现血红色证明含有铁离子;步骤⑨是调节溶液PH值4-5,结合离子沉淀PH范围分析作用是把铁离子完全沉淀;铝试剂可以对铝离子作定性检出:在醋酸及醋酸盐的弱酸性缓冲溶液(pH=4-5)中,铝离子与铝试剂生成红色络合物,流程图中步骤⑩是检验铝元素存在的操作,以此来解答.
解答:解:A.步骤②加入6mol/L盐酸,发生金属难溶物与盐酸的反应,其主要目的是为了将茶叶灰分中的钙、铁、铝难溶性化合物转化为可溶性氯化物,故A正确;
B.步骤④在pH为6-7时加热30 min,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀,所以⑤过滤后所得滤液中含Ca2+,溶质的主要成分为:CaCl2,故B错误;
C.步骤⑥可以检出钙元素存在,生成草酸钙白色沉淀,离子反应方程式为Ca2++C2O42-═CaC2O4↓,故C正确;
D.步骤⑧得到红色溶液,检验铁离子,则A试剂为KSCN溶液,离子反应方程式为Fe3++3SCN-?Fe(SCN)3,故D正确;
故选B.
B.步骤④在pH为6-7时加热30 min,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀,所以⑤过滤后所得滤液中含Ca2+,溶质的主要成分为:CaCl2,故B错误;
C.步骤⑥可以检出钙元素存在,生成草酸钙白色沉淀,离子反应方程式为Ca2++C2O42-═CaC2O4↓,故C正确;
D.步骤⑧得到红色溶液,检验铁离子,则A试剂为KSCN溶液,离子反应方程式为Fe3++3SCN-?Fe(SCN)3,故D正确;
故选B.
点评:本题考查物质的检验及推断,为高频考点,把握发生的化学反应及现象与结论的关系为解答的关键,侧重物质推断能力、综合应用知识能力的考查,题目难度不大.

练习册系列答案
相关题目