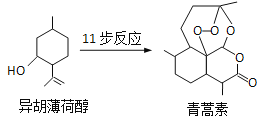
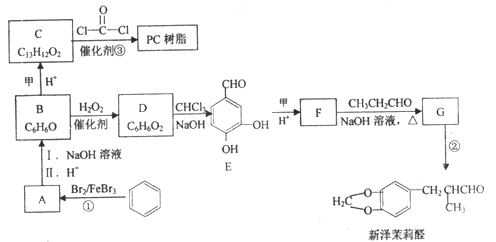
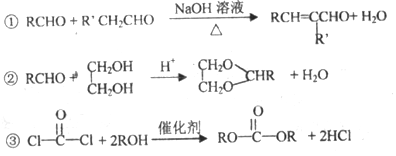
题目内容
【题目】硫、钒、钴、铂、镧的相关化合物,在药物化学及催化化学等领城应用广泛。回答下列问题:
(1)基态钒原子的电子排布式为__________,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是_______.VO43—的几何构型为_________。
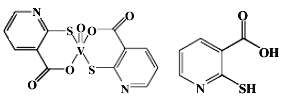
(2)2-巯基烟酸氧钒配合物(分子结构如图)是副作用小的有效调节血糖的新型药物。
①该药物中硫原子的杂化方式是_______.所含第二周期元素第一电离能由大到小的排列顺序为_____________。
②2-巯基烟酸(分子结构如图)水溶性优于2-巯基烟酸氧钒配合物的原因是___________________。
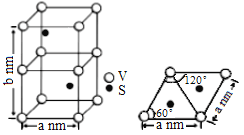
(3)某六方硫钒化合物晶体的晶胞如图所示,该晶胞的化学式为______。为该晶胞俯视图,该晶胞的密度为_____g·cm-3(NA为阿伏加德罗常数的数值.列出计算式即可)。
【答案】1s22s22p63s23p63d34s2 +5 正四面体 sp3 N>O>C 2-巯基烟酸的羧基可与水分子之间形成氢键,使其在水中溶解度增大 VS ![]()
【解析】
(1)钒为23号元素,电子排布式为1s22s22p63s23p63d34s2或[Ar]3d34s2,外围电子排布式为3d34s2,其最稳定的化合价是+5,即失去所有的价电子,形成最外层8电子的稳定结构;根据价层电子对互斥理论,VO43-中的中心原子V的价电子为5,配位原子O不提供电子,带有三个单位负电荷,所以外层电子为8个,共4对,中心原子与4个氧原子成键,故空间构型为正四面体形,故答案为:1s22s22p63s23p63d34s2或[Ar]3d34s2;+5;正四面体;
(2) ①从图中得到S的配位数为2,所以此时S的外层有6+2=8个电子,电子对为4,所以S的杂化方式是sp3杂化;其中含有的第二周期元素是C、N、O,同周期元素从左向右第一电离能呈增大趋势,因为N的2p能级上有3个电子,是p能级的半满稳定结构,所以N的第一电离能反常增大,所以第一电离能为N>O>C,故答案为:sp3;N>O>C;
②2-巯基烟酸可以与水分子形成氢键,所以其水溶性会更好,故答案为:2-巯基烟酸的羧基可与水分子之间形成氢键,使其在水中溶解度增大;
(3)晶胞中有V为:8×![]() +4×
+4×![]() =2个,S为:2×1=2个,所以化学式为VS;因为该晶胞中有2个VS,所以晶胞质量为
=2个,S为:2×1=2个,所以化学式为VS;因为该晶胞中有2个VS,所以晶胞质量为![]() g; 根据图得到晶胞的底面积为
g; 根据图得到晶胞的底面积为![]() nm2,所以晶胞的体积为:
nm2,所以晶胞的体积为:![]() ×bnm2,1nm=10-7cm,所以晶体密度为
×bnm2,1nm=10-7cm,所以晶体密度为![]() 。
。

【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )

选项 | W | X |
A | 稀硫酸 | NaAlO2溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
A. A B. B C. C D. D