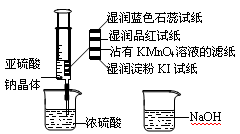
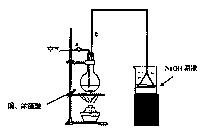
题目内容
下列变化的实质相似的是:
A.浓H2SO4和浓HCl在空气中敞口放置时浓度均减小.
B.SO2和Cl2均能使品红溶液褪色.
C.浓H2SO4和稀硫酸与锌反应均生产气体.
D浓H2SO4、浓HNO3均可以用铁制容器贮存.
A.浓H2SO4和浓HCl在空气中敞口放置时浓度均减小.
B.SO2和Cl2均能使品红溶液褪色.
C.浓H2SO4和稀硫酸与锌反应均生产气体.
D浓H2SO4、浓HNO3均可以用铁制容器贮存.
D
正确答案:D
A.不正确,浓H2SO4和浓HCl在空气中敞口放置时浓度均减小,因为浓硫酸具有吸水性,浓盐酸具有挥发性.
B.不正确,SO2和Cl2均能使品红溶液褪色,SO2与某些有机有色物质化合生成不稳定的无色物质,Cl2与水反应生成HClO具有强氧化性将品红氧化成无色物质。
C.不正确,浓H2SO4和稀硫酸与锌反应均生产气体,浓H2SO4具有强氧化性,生成SO2;稀硫酸与锌生成H2
D,正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目