题目内容
【题目】用下图所示实验装置(夹持仪器己略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
A.上下移动①中铜丝可控制SO2的产生与停止
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认有CuSO4生成,向①中加水,观察颜色
【答案】D
【解析】A.在加热的条件下,当铜丝与浓硫酸接触时才能反应,当往上抽动铜丝时,铜丝与硫酸不接触,反应停止,故可通过上下移动①中铜丝可控制SO2的量,故A不符合题意;
B.SO2具有漂白性,品红能被二氧化硫漂白,可用品红溶液验证SO2的生成,故B不符合题意;
C.SO2为酸性气体,具有污染性,可与碱发生反应,生成亚硫酸钠和水,可用NaOH溶液吸收多余的SO2 , 故C不符合题意;
D.铜与浓硫酸的反应Cu+2H2SO4 ![]() CuSO4+SO2↑+2H2O,实验中,铜丝与过量浓硫酸的反应生成是硫酸铜,试管中含有大量水,不会生成白色固体,CuSO4溶液呈蓝色,为确认CuSO4生成,应用胶头滴管将试管①中的液体取出少量,滴入水中,观察溶液颜色,若溶液显蓝色,证明有硫酸铜生成,反之则无,而不应将水加入过量的浓硫酸中,否则易产生暴沸现象,故D符合题意;
CuSO4+SO2↑+2H2O,实验中,铜丝与过量浓硫酸的反应生成是硫酸铜,试管中含有大量水,不会生成白色固体,CuSO4溶液呈蓝色,为确认CuSO4生成,应用胶头滴管将试管①中的液体取出少量,滴入水中,观察溶液颜色,若溶液显蓝色,证明有硫酸铜生成,反之则无,而不应将水加入过量的浓硫酸中,否则易产生暴沸现象,故D符合题意;
故答案为:D。根据铜与浓硫酸反应的条件和实验现象进行判断即可。

【题目】NH3及其盐都是重要的化工原料. 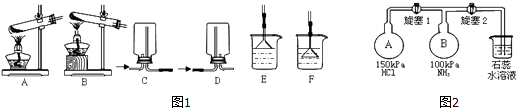
(1)用NH4Cl和Ca(OH)2制备NH3的化学方程式为;该反应发生、气体收集和尾气处理装置如图1依次为;
(2)按如图2装置进行NH3性质实验.先打开旋塞1,B瓶中的现象是 , 稳定后,关闭旋塞1.再打开旋塞2,B瓶中的现象是;
(3)写出NH4Cl溶液水解的离子方程式;
设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响.
限选试剂与仪器:固体NH4Cl、蒸馏水、250mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可调控温度)
①实验目的:探究对溶液中NH4Cl水解程度的影响;
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中“V(溶液)”表示所配制溶液的体积).
物理量 | V(溶液)/mL | NH4Cl质量/g | 温度/℃ | … | |
1 | 250 | X | … | ||
2 | 250 | … |
③按实验序号1所拟数据进行实验,若读取的待测物理量的数值为X,则NH4Cl水解反应的平衡转化率为(只列出算式,忽略水自身电离的影响).
【题目】SO2的含量是空气质量日报中一项重要检测指标,请结合所学知识回答下列问题.
(1)工业制硫酸过程中,SO2催化氧化的原理为: 2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图1所示.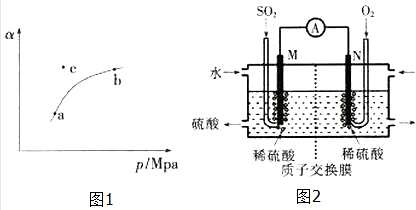
①a、b两点对应的平衡常数K(a)K(b)(填“>”、“<”或“=”,下同),SO2浓度c(a)c(b).
②c点时,反应速率v(正)v(逆) .
(2)电化学法处理SO2 . 硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图2所示(电极均为惰性材料):
①M极发生的电极反应式为 .
②若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为L(已知:1个e﹣所带电量为1.6×10﹣19C).
(3)溶液法处理SO2 . 已知常温下H2SO3和H2CO3的电离常数如表所示:
电离常数 | K1 | K2 |
H2SO3 | 1.3×10﹣2 | 6.3×10﹣8 |
H2CO3 | 4.2×10﹣7 | 5.6×10﹣11 |
常温下,将SO2缓慢通入100mL 0.2molL﹣1的Na2CO3溶液中,当通入448mLSO2时(已折算为标准状况下的体积,下同),发生的离子方程式为;当通入896mLSO2时,所得溶液呈弱酸性,溶液中各离子浓度由大到小的顺序为