题目内容
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为该电池的工作原理示意图,该电池的电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定。请回答:
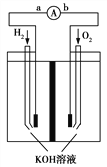
(1)氢氧燃料电池放电时能量转化形式主要是________,
在导线中电子流动方向为________(用a.b表示)。
(2)负极反应式为__________________。
(3)电极表面镀铂粉的原因为__________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.Li+H2![]() 2LiH Ⅱ.LiH+H2O===LiOH+H2↑
2LiH Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是____________。
②知LiH固体的密度为0.82 g/cm3。用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③将由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________mol。
【答案】 由化学能转变为电能 由a到b(表达形式合理均可) 2H2+4OH--4e-===4H2O或H2+2OH--2e-===2H2O 增大电极单位面积吸附H2、O2的分子数,加快电极反应速率 Li H2O 8.71×10-4∶1 32
【解析】(1)该装置是把化学物质中的能力转化为电能,所以是化学能转变为电能;在原电池中,负极上失电子,正极上得电子,电子的流向是从负极流向正极,所以是由a到b;
(2)该反应中负极上氢气失电子生成氢离子而被氧化,所以电极反应式为H2+2OH--2e-═2H2O或2H2+4OH--4e-═4H2O;
(3)电极表面镀铂粉,增大了电极单位面积吸附H2、O2的分子数,使反应物的浓度增大,反应物浓度增大,反应速率加快;
(4)①Ⅰ.Li+H2![]() 2LiH中锂失电子作还原剂,Ⅱ.LiH+H2O═LiOH+H2↑中水得电子作氧化剂; ②氢气的物质的量=
2LiH中锂失电子作还原剂,Ⅱ.LiH+H2O═LiOH+H2↑中水得电子作氧化剂; ②氢气的物质的量=![]() =10mol,当吸收10molH2时,则生成20molLiH,生成LiH的体积为
=10mol,当吸收10molH2时,则生成20molLiH,生成LiH的体积为![]() =0.195L,故生成的LiH体积与被吸收的H2体积比为
=0.195L,故生成的LiH体积与被吸收的H2体积比为![]() =8.71×10-4∶1;③氢气的物质的量=10mol,当吸收10molH2时,则生成20molLiH,20molLiH可生成20mol H2,实际参加反应的H2为20mol×80%=16mol,1molH2转化成1molH2O,转移2mol电子,所以16molH2可转移32mol的电子。
=8.71×10-4∶1;③氢气的物质的量=10mol,当吸收10molH2时,则生成20molLiH,20molLiH可生成20mol H2,实际参加反应的H2为20mol×80%=16mol,1molH2转化成1molH2O,转移2mol电子,所以16molH2可转移32mol的电子。

 阅读快车系列答案
阅读快车系列答案【题目】二氧化碳的回收利用是环保领域研究的热点课题。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示,其总反应的化学方程式为_________。

(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H,几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
CH2=CH2(g)+4H2O(g)△H,几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
物质 | H2(g) | CO2(g) | CH2=CH2(g) | H2O(g) |
能量/kJmol-1 | 0 | -394 | 52 | -242 |
则△H=_________。
(3)在2L恒容密闭容器中充入2molCO2和nmolH2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X= ![]() ]的关系如图2所示。
]的关系如图2所示。
①X1_________X2(填“>”、“<”或“=”,下同),平衡常数KA_________KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=_________。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如图3。
①b电极的名称是_________;
②产生丙烯的电极反应式为_______________。

