题目内容
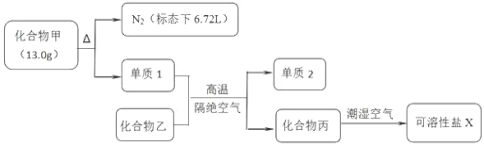
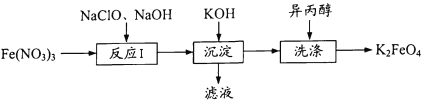
【题目】高铁酸钾(K2FeO4)既能消毒杀菌,又能净水,是一种理想的水处理剂。工业 上制备高铁酸钾的一种工艺流程如下:
(1)K2FeO4中铁元素的化合价为 ____。
(2) “反应I”中参加反应的Fe3+与ClO-的物质的量之比为2 : 3,则滤液中含氯物质的化学式为____。写出“反应I”的离子方程式:_____。
(3)K2FeO4在水中发生反应:4K2FeO4+ 10H2O = 4Fe(OH)3 (胶体)+8KOH+3O2 ↑。高铁酸钾能消毒杀菌是因为____;它能净水是因为_____。
【答案】+6 NaCl 2Fe3+ + 3ClO-+10OH-= 2FeO42-+3Cl-+5H2O 具有强氧化性 生成的Fe(OH)3胶体具有吸附作用,可以吸附水中的杂质
【解析】
有流程可知Fe(NO3)3在碱性条件下与NaClO发生氧化还原反应生成硝酸钠、高铁酸钠、氯化钠和水,向反应所得溶液中加入氢氧化钾,析出溶解度较小的K2FeO4,用异丙醇洗涤得到K2FeO4。
(1)由化合价代数和为零可知K2FeO4中铁元素的化合价为+6价,故答案为:+6;
(2)设滤液中含氯物质的化合价为x,由得失电子数目守恒可得(6—3)×2=(1—x)×3,解得x=—1,则滤液中含氯物质为NaCl,由此可知Fe(NO3)3在碱性条件下与NaClO发生氧化还原反应生成硝酸钠、高铁酸钠、氯化钠和水,反应的离子方程式为2Fe3+ + 3ClO-+10OH-= 2FeO42-+3Cl-+5H2O,故答案为:NaCl;2Fe3+ + 3ClO-+10OH-= 2FeO42-+3Cl-+5H2O;
(3)高铁酸钾具有强氧化性,能起到杀菌消毒的作用,杀菌消毒过程中高铁酸钾被还原生成的Fe(OH)3胶体具有吸附作用,可以吸附水中的杂质,可以达到净水的作用,故答案为:具有强氧化性;生成的Fe(OH)3胶体具有吸附作用,可以吸附水中的杂质。

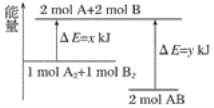
【题目】在800℃时,2L密闭容器内发生反应:2NO(g)+O2(g)2NO2(g),反应体系中,一氧化氮的物质的量随时间的变化如表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示NO2的物质的量浓度变化的曲线是________。
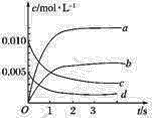
(2)用O2表示从0~2 s内该反应的平均速率v=__________。
(3)能说明该反应已达到平衡状态的是________。
A.v(NO2)=2v(O2)
B.容器内压强保持不变
C.容器内气体质量不变
D.容器内密度保持不变
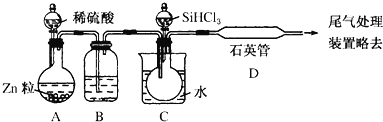
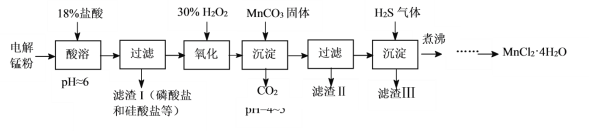
【题目】某科研小组采用电解锰粉(主要成分为Mn和少量含Fe、Ni、Pb、P、Si等元素的单质或其化合物)为原料制备高纯氯化锰。
已知:①Mn是一种比Fe活泼的金属。
②H2S气体具有较强的还原性,如:H2S+H2O2=S↓+2H2O。
③相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
Fe3+ | Fe2+ | Mn2+ | Ni2+ | Pb2+ | |
开始沉淀的pH | 1.1 | 5.8 | 8.6 | 6.7 | 8.0 |
沉淀完全的pH | 3.2 | 8.8 | 10.1 | 9.2 | 8.8 |
(1)酸溶时盐酸要缓慢滴加的原因是___。
(2)加入MnCO3固体时发生反应的离子方程式为___。MnCO3固体也可用下列物质代替___。(填写编号)
A.MnO B.MnSO4 C.Mn(OH)2 D.MnCl2
(3)通入H2S气体可使Pb2+、Ni2+生成硫化物沉淀,如:H2S(aq)+Pb2+(aq)![]() PbS(s)+2H+(aq),该反应的平衡常数K=___[用Ka1(H2S)、Ka2(H2S)及Ksp(PbS)表示]。
PbS(s)+2H+(aq),该反应的平衡常数K=___[用Ka1(H2S)、Ka2(H2S)及Ksp(PbS)表示]。
(4)煮沸的目的是___。
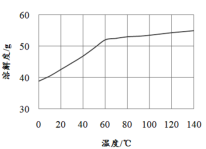
(5)已知MnCl2·4H2O在106℃时失去一分子结晶水,198℃失去全部结晶水。请补充完整由煮沸后的滤液获得高纯(>99.99%)MnCl2·4H2O晶体(MnCl2的溶解度曲线如图所示)的实验方案:将煮沸后的滤液冷却至室温,___(实验中须使用的试剂是:30%H2O2)。