题目内容
二氧化锰(MnO2)与浓盐酸混合加热可得到氯气、氯化锰等,如图是制取并探究Cl2化学性质的装置图.
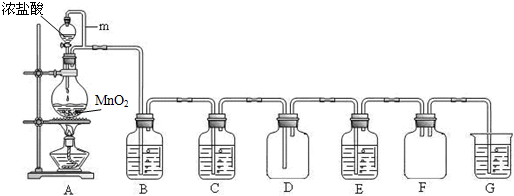
(1)写出圆底烧瓶中反应的化学方程式
(2)A中m管的作用是
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是
(4)E中若装有FeCl2溶液,反应的离子方程式为
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气.针对上述现象,化学小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体,加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成.由此得出影响氯气生成的原因是

(1)写出圆底烧瓶中反应的化学方程式
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||
(2)A中m管的作用是
平衡气压,使分液漏斗中的液体顺利下滴
平衡气压,使分液漏斗中的液体顺利下滴
;装置F的作用是防止G中液体倒吸至E中
防止G中液体倒吸至E中
.(3)若要得到干燥纯净的气体,则B中应盛放的试剂是
饱和食盐水(饱和NaCl溶液),
饱和食盐水(饱和NaCl溶液),
,C中应盛放的试剂是浓硫酸
浓硫酸
.(4)E中若装有FeCl2溶液,反应的离子方程式为
2Fe2++Cl2=2Fe3++2Cl-;
2Fe2++Cl2=2Fe3++2Cl-;
;E中若装有淀粉碘化钾溶液,能观察到的实验现象是无色溶液显蓝色
无色溶液显蓝色
.(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气.针对上述现象,化学小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体,加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是
探究Cl-浓度的影响
探究Cl-浓度的影响
;实验c的目的是探究H+浓度的影响
探究H+浓度的影响
.②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成.由此得出影响氯气生成的原因是
H+浓度的大小
H+浓度的大小
.分析:(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,注意稀盐酸和二氧化锰不反应.
(2)只有有压强差时溶液才能从分液漏斗中流下;氯气极易溶于氢氧化钠溶液而产生倒吸现象,为防止 倒吸,应有缓冲装置.
(3)根据氯化氢和氯气的性质分析选用除杂试剂;浓硫酸常常干燥能和碱反应气体.
(4)氯气有强氧化性,能把二价铁离子氧化为三价铁离子,能把碘离子氧化为碘单质,碘遇淀粉变蓝色.
(5)比较浓度变化的离子对化学反应是否有影响,从而得出结论.
(2)只有有压强差时溶液才能从分液漏斗中流下;氯气极易溶于氢氧化钠溶液而产生倒吸现象,为防止 倒吸,应有缓冲装置.
(3)根据氯化氢和氯气的性质分析选用除杂试剂;浓硫酸常常干燥能和碱反应气体.
(4)氯气有强氧化性,能把二价铁离子氧化为三价铁离子,能把碘离子氧化为碘单质,碘遇淀粉变蓝色.
(5)比较浓度变化的离子对化学反应是否有影响,从而得出结论.
解答:(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
,注意稀盐酸和二氧化锰不反应.
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O.
(2)只有有压强差时溶液才能从分液漏斗中流下,所以m管的作用是平衡气压,使分液漏斗中的液体顺利下滴;
氯气极易溶于氢氧化钠溶液而产生倒吸现象,为防止 倒吸,应有缓冲装置,所以F的作用是防止G中液体倒吸至E中.
故答案为:平衡气压,使分液漏斗中的液体顺利下滴;防止G中液体倒吸至E中.
(3)制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和 水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢应饱和食盐水;浓硫酸常常干燥能和碱反应气体,故选浓硫酸.
故答案为:饱和食盐水(饱和NaCl溶液),浓硫酸.
(4)氯气有强氧化性,能把二价铁离子氧化为三价铁离子自身被还原为氯离子2Fe2++Cl2=2Fe3++2Cl-; 能把碘离子氧化为碘单质,碘遇淀粉变蓝色,所以会看到无色溶液显蓝色.
故答案为:2Fe2++Cl2=2Fe3++2Cl-; 无色溶液显蓝色.
(5)①实验b:加入NaCl固体前后,溶液中浓度变化的离子是氯离子,所以探究的是氯离子浓度的影响;
实验c:加入浓硫酸前后,溶液中浓度变化的离子是氢离子,所以探究的是氢离子浓度的影响.
故答案为:探究Cl-浓度的影响;探究H+浓度的影响.
②由实验现象知,氢离子的浓度越大,越有氯气生成,氢离子的浓度越小,越没有氯气生成,由此得出影响氯气生成的原因是氢离子的浓度.
故答案为:H+浓度的大小.
| ||
,注意稀盐酸和二氧化锰不反应.
故答案为:MnO2+4HCl(浓)
| ||
(2)只有有压强差时溶液才能从分液漏斗中流下,所以m管的作用是平衡气压,使分液漏斗中的液体顺利下滴;
氯气极易溶于氢氧化钠溶液而产生倒吸现象,为防止 倒吸,应有缓冲装置,所以F的作用是防止G中液体倒吸至E中.
故答案为:平衡气压,使分液漏斗中的液体顺利下滴;防止G中液体倒吸至E中.
(3)制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和 水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢应饱和食盐水;浓硫酸常常干燥能和碱反应气体,故选浓硫酸.
故答案为:饱和食盐水(饱和NaCl溶液),浓硫酸.
(4)氯气有强氧化性,能把二价铁离子氧化为三价铁离子自身被还原为氯离子2Fe2++Cl2=2Fe3++2Cl-; 能把碘离子氧化为碘单质,碘遇淀粉变蓝色,所以会看到无色溶液显蓝色.
故答案为:2Fe2++Cl2=2Fe3++2Cl-; 无色溶液显蓝色.
(5)①实验b:加入NaCl固体前后,溶液中浓度变化的离子是氯离子,所以探究的是氯离子浓度的影响;
实验c:加入浓硫酸前后,溶液中浓度变化的离子是氢离子,所以探究的是氢离子浓度的影响.
故答案为:探究Cl-浓度的影响;探究H+浓度的影响.
②由实验现象知,氢离子的浓度越大,越有氯气生成,氢离子的浓度越小,越没有氯气生成,由此得出影响氯气生成的原因是氢离子的浓度.
故答案为:H+浓度的大小.
点评:本题考查了氯气的实验室制法及化学性质,难度不大,氯气的氧化性、二价铁离子和三价铁离子的检验是高考的热点.

练习册系列答案
相关题目