��Ŀ����
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A. ��ʯī���缫���ʳ��ˮʱ���������õ�2NA�����ӣ�������һ������22.4 LCl2�����ۻ���ɱ�״���µ������
B. 2 L 0.05 mol��L��1�Ҵ���Һ�к���Hԭ����ĿΪ0.1NA
C. 4.0 g H![]() O��D2O�Ļ����������������Ϊ2NA
O��D2O�Ļ����������������Ϊ2NA
D. �����£�1 mol��NaHCO3������HCO![]() �ĸ����ض�С��NA
�ĸ����ض�С��NA
���𰸡�C
��������A. ��ʯī���缫���ʳ��ˮʱ�����������ӷŵ磬�������õ�2NA�����ӣ�����������1mol������������������ʳ��ˮ�����С��22.4 L����A����B. 2 L 0.05 mol��L��1�Ҵ���Һ���Ҵ������ʵ���Ϊ0.1mol����������Hԭ����ĿΪ����0.1NA����B����C. H![]() O��D2O����Է���������Ϊ20����������Ϊ10����4.0 g�˻��������ʵ���Ϊ0.2nol������������Ϊ2NA����C��ȷ��D. NaHCO3����Ϊ���Ӿ��壬�����£�1 mol��NaHCO3������HCO
O��D2O����Է���������Ϊ20����������Ϊ10����4.0 g�˻��������ʵ���Ϊ0.2nol������������Ϊ2NA����C��ȷ��D. NaHCO3����Ϊ���Ӿ��壬�����£�1 mol��NaHCO3������HCO![]() �ĸ�������NA����D����ѡC��
�ĸ�������NA����D����ѡC��

����Ŀ����ͼ�����÷�ͭм�������ʣ��Ʊ�����������ͭ���壩�Ĺ��� 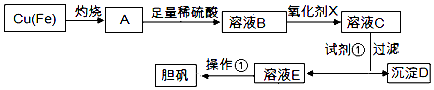
��֪��
��Һ�б����������� | Fe3+ | Fe2+ | Cu2+ |
��ȫ������������ij���ʱ����Һ��pH | ��3.7 | ��6.4 | ��4.4 |
��ش�
��1��������������������������X����������ĸ����
A.NaClO
B.H2O2
C.KMnO4
D.FeCl3
��2�������Լ�����Ϊ�˵���pH���Լ��ٿ���ѡ�����ѧʽ����
��3�������ٵ������� ��
��4������D����������Եõ�FeCl3��Һ������FeCl3��Һ��������˵������ȷ���� ��
A.��FeCl3������Һ��μ����ˮ�У����������ȵõ����ɫҺ�壬��Һ���ܲ��������ЧӦ
B.��FeCl3��Һ�μ�NaOH��Һ�����ֺ��ɫ����
C.��FeCl3��Һ�μ�NaOH��Һ���������������գ��õ�Fe��OH��3����
D.��FeCl3��Һ�еμ�KSCN��Һ����Һ��Ϊ��ɫ
��5������D������������ۣ������Ƶ�FeCl2��Һ��ʵ���ұ���FeCl2��Һ���������������۷�ֹFeCl2��Һ���ʣ���ԭ�����������ӷ���ʽ��ʾ����
��6������̼�缫�������ͭ��Һ200mL��ͨ��5min����������0.64g���������Һ��pH=����Һ����仯���Բ��ƣ���