题目内容
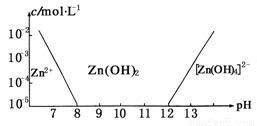
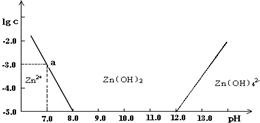
如图:横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数,回答下列问题.
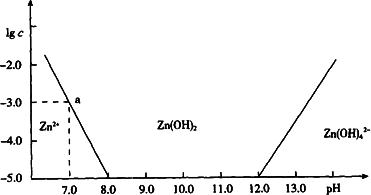
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:________.
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)![]() ________.
________.
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是________.
(4)往1.00 L 1.00 mol·L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH________mol
(5)已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如下:
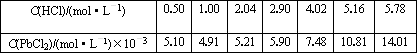
根据上表数据判断下列说法正确的是________(填字母序号)
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol·L-1盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(如配合离子)
D.PbCl2固体可溶于饱和食盐水
解析:
|
(1)Zn2++4OH- (2)10-17(2分); (3)(8.0,12.0)(2分); (4)1.80(2分,写1.8得1分); (5)ABCD(3分,写对1个得0分,写对2个得1分,写对3个得2分,漏1个扣1分,扣完为止). |

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为____________。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)=___________。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH的范围是____________。
(4)往
(5)已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;
c(HCl)/mol·L-1 | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
c(PbCl2)/mol·L-1×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
根据上表数据判断下列说法正确的是___________(填字母序号)。
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol·L—1盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(如配合离子)
D.PbCl2固体可溶于饱和食盐水
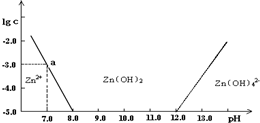 常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的pH,纵坐标为Zn2+ 或Zn(OH)42-(配离子)物质的量浓度的对数(假设Zn2+离子浓度为10-5mol?L-1时,Zn2+离子已沉淀完全).下列说法正确的是( )
常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的pH,纵坐标为Zn2+ 或Zn(OH)42-(配离子)物质的量浓度的对数(假设Zn2+离子浓度为10-5mol?L-1时,Zn2+离子已沉淀完全).下列说法正确的是( )