题目内容
常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的pH,纵坐标为Zn2+ 或Zn(OH)42-(配离子)物质的量浓度的对数(假设Zn2+离子浓度为10-5mol?L-1时,Zn2+离子已沉淀完全).下列说法正确的是( )
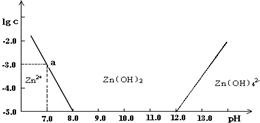
| A.从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17 |
| B.pH<12的溶液中不存在Zn(OH)42- |
| C.某废液中含Zn2+离子,沉淀Zn2+离子可以控制溶液pH的范围是8~12 |
| D.向1L 1mol?L-1ZnC12溶液中加入NaOH固体至pH=7,需NaOH 2mol |

A.Zn2+离子浓度为10-5mol?L-1时,Zn2+离子已沉淀完全,当溶液的pH=8.0时,c(Zn2+)=10-5 mol?L-1,c(OH-)=10-6 mol?L-1,Ksp=c(Zn2+).c2(OH-)=10-5?(10-6)2=10-17,故A正确;
B.pH<12的溶液中存在Zn(OH)42-,只是物质的量浓度小于10-5mol?L-1时,可以认为Zn(OH)42-不存在,故B错误;
C.根据图象知,溶液的pH范围为8<pH<12时,溶液中锌离子浓度小于10-5 mol?L-1,可以近似认为锌离子不存在,故C正确;
D.根据图象知,pH=7时,C(Zn2+)=10-3mol/L,即只有部分锌离子生成氢氧化锌沉淀,则加入的n(NaOH)<2n(ZnCl2),故D错误;
故选AC.
B.pH<12的溶液中存在Zn(OH)42-,只是物质的量浓度小于10-5mol?L-1时,可以认为Zn(OH)42-不存在,故B错误;
C.根据图象知,溶液的pH范围为8<pH<12时,溶液中锌离子浓度小于10-5 mol?L-1,可以近似认为锌离子不存在,故C正确;
D.根据图象知,pH=7时,C(Zn2+)=10-3mol/L,即只有部分锌离子生成氢氧化锌沉淀,则加入的n(NaOH)<2n(ZnCl2),故D错误;
故选AC.

练习册系列答案
相关题目
常温下二价锌在水溶液中的存在形式与pH的关系如图,纵坐标为Zn2+或Zn(OH)42-物质的量浓度的对数。下列说法正确的是
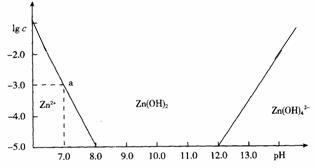 |
A.pH<12的溶液中不存在Zn(OH)42-
B.如果溶液中c(Zn2+)=0.1 mol?L-1 ,则c(H+)≥1×10-6 mol?L-1
C.控制pH在8~12可以分离出溶液中的锌离子
D.Zn(OH)2(s)![]() Zn2+(aq)+ 2OH-(aq)的平衡常数为1×10-10
Zn2+(aq)+ 2OH-(aq)的平衡常数为1×10-10
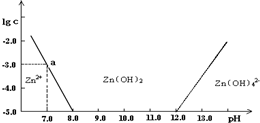 常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的pH,纵坐标为Zn2+ 或Zn(OH)42-(配离子)物质的量浓度的对数(假设Zn2+离子浓度为10-5mol?L-1时,Zn2+离子已沉淀完全).下列说法正确的是( )
常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的pH,纵坐标为Zn2+ 或Zn(OH)42-(配离子)物质的量浓度的对数(假设Zn2+离子浓度为10-5mol?L-1时,Zn2+离子已沉淀完全).下列说法正确的是( )