题目内容
【题目】能源危机是当前全球问题,开源节流是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是________(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。

在通常状况下,金刚石和石墨中________(填“金刚石”或“石墨”)更稳定.
(3)二甲醚又称甲醚,简称DME,熔点为-141.5℃,沸点为-24.9℃。二甲醚与液化石油气(LPG)相似,被誉为“21世纪的清洁燃料”。由合成气(CO、H2)制备二甲醚的反应原理如下:
a.CO(g)+2H2(g)![]() CH3OH(g) △H1= -90.0 kJ·mol-1
CH3OH(g) △H1= -90.0 kJ·mol-1
b.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mol-l
CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mol-l
回答下列问题:
①反应a在__________ (填“低温”或“高温”)下易自发进行。
②写出由合成气(CO、H2) 直接制备二甲醚的热化学方程式:__________________________________。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质b是__________, 阳极电极反应为__________________________________________________。
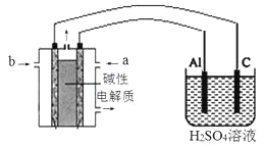
【答案】 acd 石墨 低温 2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) △H= -200 kJ·mol-l 甲醇(或CH3OH) 2Al+3H2O-6e- =Al2O3 +6H+
CH3OCH3(g)+H2O(g) △H= -200 kJ·mol-l 甲醇(或CH3OH) 2Al+3H2O-6e- =Al2O3 +6H+
【解析】(1)只要能减少化石燃料等资源的运用都属于“开源节流”;(2)依据物质能量越高,物质越不稳定;(3)依据△G=△H-T△S判断反应的自发性,结合热化学方程式和盖斯定律计算得到;(4)根据电解池确定阴阳极,然后确定燃料电池的正负极,写出电极反应式。
(1)大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源,有助于能源“开源节流”,a选项符合要求;煤、石油、天然气都是化石燃料,是不可再生的,所以大力开采煤、石油和天然气以满足人们日益增长的能源需求是错误的,不可取的,b选项不符合要求;开发新能源、减少使用煤、石油等化石燃料,c选项符合要求;减少资源消耗,增加资源的重复使用、循环再生,d选项符合要求,正确选项acd;
(2)根据图像可知,金刚石的总能量大于石墨的,所以石墨比金刚石稳定,正确答案:石墨;
(3)①CO(g)+2H2(g)![]() CH3OH(g); △H1= -90.0 kJ·mol-1,△S<0,△H<0,反应能够自发进行,说明在△G=△H-T△S中△G<0,所以T的值要小,即低温下自发进行,正确答案:低温;
CH3OH(g); △H1= -90.0 kJ·mol-1,△S<0,△H<0,反应能够自发进行,说明在△G=△H-T△S中△G<0,所以T的值要小,即低温下自发进行,正确答案:低温;
②根据盖斯定律,将①×2+②得:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) △H= -200 kJ·mol-l,正确答案:2CO(g)+4H2(g)
CH3OCH3(g)+H2O(g) △H= -200 kJ·mol-l,正确答案:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) △H= -200 kJ·mol-l;
CH3OCH3(g)+H2O(g) △H= -200 kJ·mol-l;
(4)铝制品表面 “钝化”处理过程是铝失去电子生成Al2O3的过程,所以铝是阳极,对应的燃料电池是正极,所以a通入的是氧气,b极是甲醇,铝电极发生反应的电极方程式:2Al-6e-+3H2O=Al2O3+6H+,正确答案:甲醇;2Al-6e-+3H2O=Al2O3+6H+。