题目内容
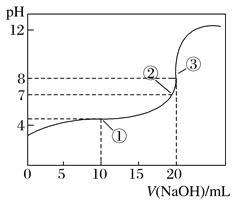
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是
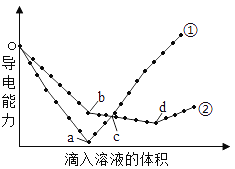
A.b→d反应的离子方程式为:H++OH-=H2O
B.o→a反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.c点导电能力相同,所以两溶液中含有相同量的OH–
D.a、b两点Ba2+均沉淀完全,所以对应的溶液均显中性
【答案】A
【解析】
Ba(OH)2溶液和H2SO4、NaHSO4溶液反应方程式分别为H2SO4+Ba(OH)2=BaSO4↓+2H2O、NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,溶液导电能力与离子浓度成正比,根据图知,曲线①在a点溶液导电能力接近0,说明该点溶液离子浓度最小,应该为Ba(OH)2溶液和H2SO4的反应,则曲线②为Ba(OH)2溶液和NaHSO4溶液的反应,然后对选项分析、解答。
根据上述分析可知曲线①表示Ba(OH)2溶液和H2SO4的反应;曲线②为Ba(OH)2溶液和NaHSO4溶液的反应。
A.曲线②为Ba(OH)2溶液和NaHSO4溶液的反应,其中0→b段发生的反应为:NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,b→d反应是NaOH+NaHSO4=Na2SO4+H2O,离子方程式为:H++OH-=H2O,A正确;
B.曲线①表示Ba(OH)2溶液和H2SO4的反应,o→a反应为:H2SO4+Ba(OH)2=BaSO4↓+2H2O,离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,B错误;
C.根据图示可知c点导电能力相同,对于曲线a是过量的H2SO4电离产生的离子导电,对于曲线②,c点是反应产生的NaOH电离产生的离子导电,所以两溶液中含有的OH–不相同,C错误;
D.a点是Ba(OH)2溶液和H2SO4恰好反应产生BaSO4沉淀,此时溶液中只有水,溶液显中性,b点恰好发生反应:NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,所对应的溶液为NaOH溶于,显碱性,D错误;
故合理选项是A。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案【题目】学习中经常应用类推法。下列表格左边正确,类推法应用于右边也正确的是( )
A | 向FeCl2溶液中滴入氯水 2Fe2++Cl2=2Fe3++2Cl— | 向FeCl2溶液中滴入碘水 2Fe2++I2=2Fe3++2I— |
B | 向澄清石灰水中通入少量CO2气体 Ca2++2OH—+CO2 =CaCO3↓+H2O | 向澄清石灰水中通入少量SO2 气体 Ca2++2OH—+SO2=CaSO3↓+H2O |
C | 向Na2CO3溶液中滴入稀HNO3
| 向Na2SO3溶液中滴入稀HNO3
|
D | 锌粒放入硫酸亚铁溶液中 Zn+Fe2+=Zn2++Fe | 钠投入硫酸铜溶液中 2Na+Cu2+=2Na++Cu |
A. A B. B C. C D. D