题目内容
(27分)(1)现有如下两个反应:①NaOH + HCl =" NaCl" + H2O;②Fe +H2SO4 = FeSO4 + H2 ↑
两反应中为放热反应的是 ,能设计成原电池的是 。(填序号)
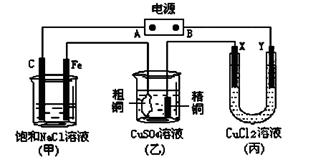
(2)根据下图填空①电子从 片流出,溶液中H+向 片移动。
② 正极的现象是 ,发生 反应(填写“氧化”或“还原”)。
③负极的电极方程式为
④ 若反应过程中有0.01mol电子发生转移,则生成的氢气在标准状况下的体积为 L。
(3)写出电解氯化铜溶液时,阴极的电极反应方程式: 。
(1)①②; ②
(2) ①Zn ; Cu; ②有气泡产生; 还原; ③Zn—2e—==Zn2+; ④0.112
(3)Cu2++2e—= Cu
解析试题分析:(1)①是酸碱中和反应,是放热反应;②是置换反应,属于放热反应;能设计成原电池的反应应该是有电子转移的氧化还原反应,②有化合价的升降,是氧化还原反应,可以设计为原电池。(2)① 在该原电池中Zn为负极,失去电子,电子从Zn片流出。经过导线,流回正极Cu。在溶液中根据同种电荷相互排斥,异种电荷相互吸引的原则,H+向含有负电荷较多的正极Cu片移动。② 在正极Cu上发生反应:2H++2e-=H2↑,反应类型是还原反应,看到的现象是有气泡产生。③在负极上Zn失去电子,被氧化。负极的电极方程式为Zn—2e—==Zn2+;④ 若反应过程中有0.01mol电子发生转移,根据电子守恒,可得n(H2)=0.005mol,所以生成的氢气在标准状况下的体积为0.005mol×22.4L/mol=0.112L.(3)电解氯化铜溶液时,在阴极上Cu2+得到电子,发生还原反应。该电极反应方程式:Cu2++2e—= Cu。
考点:考查

下列有关电池叙述不正确的是( )
| A.锌锰干电池是一种常用的二次电池 |
| B.氢氧燃料电池比火力发电的能量转变率要高 |
| C.锌锰干电池工作一段时间后锌外壳逐渐变薄 |
| D.碱性燃料电池正极反应是O2 + 2H2O + 4e- =4OH- |
某化学小组用下图装置电解CuCl2溶液制少量漂白液: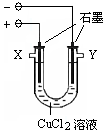

(1)其阳极的反应式是: ;导气管W端应与出气口 连接。
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质。
查阅资料显示:
| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2( OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
化学小组分析提出:①红色物质可能有 、或Cu2O、或二者都有;②白色物质为CuCl
(3)为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:
取出阴极碳棒,洗涤、干燥、称其质量为W1g ,并将其放入下图所示装置b中,

进行实验。实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g 。
①碳棒上的红色物质是 ,无水硫酸铜的作用是 ;
②d中反应的离子方程式是 ;
③装置b中发生反应的化学方程式是 。
④电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为 。
⑤阴极上产生白色物质的物质的量是 ;若装置b冷却时不继续通H2,则计算所得Cu+的产率会 (偏大、偏小、不变)。

 则反应2SO2(g)+O2(g) 2SO3(g)的△H= kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能 (填“增大”、“不变”或“减小”)。
则反应2SO2(g)+O2(g) 2SO3(g)的△H= kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能 (填“增大”、“不变”或“减小”)。