题目内容
某有机物A的相对分子质量为62.为进一步测定A的化学式,现取6.2gA完全燃烧,得到二氧化碳和水蒸气.将产物先后通过足量的浓硫酸和碱石灰,两者分别增重5.4g和8.8g(假设每步反应完全).
(1)该有机物的实验式是______:分子式是______.
(2)红外光谱显示有“C-C”键和“O一H”键的振动吸收,若核磁兆振氢谱有2个吸收峰,峰面积之比为1:2,推断该有机物的结构简式是______.
(3)该有机物与金属钠反应的化学方程式是______.
(1)该有机物的实验式是______:分子式是______.
(2)红外光谱显示有“C-C”键和“O一H”键的振动吸收,若核磁兆振氢谱有2个吸收峰,峰面积之比为1:2,推断该有机物的结构简式是______.
(3)该有机物与金属钠反应的化学方程式是______.
(1)根据化学反应前后各元素的质量不变,反应后生成的物质中:含C元素的质量为:8.8×
=2.4g,含H元素的质量为:5.4×
=0.6g,以上C和H元素有该化合物提供,质量共为3g,而提供的化合物质量为6.2g,所以有机物A中还有3.2g元素.该化合物中各元素的原子个数比为:
:
:
=1:3:1,该物质的实验式为CH3O,分子式为 (CH3O)n,有机物A的相对分子质量为62,则n=2,则有机物分子式为C2H6O2,
故答案为:CH3O;C2H6O2;
(2)红外光谱显示有“C-C”键和“O一H”键的振动吸收,若核磁兆振氢谱有2个吸收峰,峰面积之比为1:2,据此结合有机物的分子式,所以符合结构特征的有机物A的结构简式为:CH2OHCH2OH,故答案为:HOCH2CH2OH;
(3)该有机物A为CH2OHCH2OH,A与足量金属钠反应的化学方程式为:HOCH2CH2OH+2Na→NaOCH2CH2ONa+H2↑,故答案为:HOCH2CH2OH+2Na→NaOCH2CH2ONa+H2↑;
| 12 |
| 44 |
| 2 |
| 18 |
| 2.4 |
| 12 |
| 0.6 |
| 1 |
| 3.2 |
| 16 |
故答案为:CH3O;C2H6O2;
(2)红外光谱显示有“C-C”键和“O一H”键的振动吸收,若核磁兆振氢谱有2个吸收峰,峰面积之比为1:2,据此结合有机物的分子式,所以符合结构特征的有机物A的结构简式为:CH2OHCH2OH,故答案为:HOCH2CH2OH;
(3)该有机物A为CH2OHCH2OH,A与足量金属钠反应的化学方程式为:HOCH2CH2OH+2Na→NaOCH2CH2ONa+H2↑,故答案为:HOCH2CH2OH+2Na→NaOCH2CH2ONa+H2↑;

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
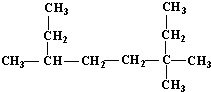 的名称为______
的名称为______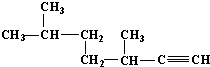 的名称为______
的名称为______