题目内容
19. 白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.(1)已知298K时白磷、红磷完全燃烧的热化学方程式分别为:
(s,白磷)+5O2(g)═P4O10(s)△H1=-2 983.2kJ•mol-1
P(s,红磷)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H2=-738.5kJ•mol-1
则该温度下白磷转化为红磷的热化学方程式为P4(s,白磷)=4P(s,红磷)△H=-29.2kJ/mol.
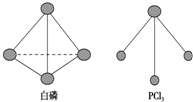
(2)已知白磷和PCl3的分子结构如图所示,现提供以下化学 键的键能:P-P 198kJ•mol-1,
Cl-Cl 243kJ•mol-1,P-Cl 331kJ•mol-1.则反应P4(s,白磷)+6Cl2(g)═4PCl3(s)的反应热
△H=-1326kJ/mol.
分析 (1)根据盖斯定律写出白磷转化为红磷的热化学方程式;
(2)依据反应焓变△H=反应物键能总和-生成物键能总和得到.
解答 解:(1)P4(s,白磷)+5O2(g)=P4O10(s)△H1=-2983.2kJ/mol①
P(s,红磷)+$\frac{5}{4}$O2(g)=$\frac{1}{4}$P4O10(s)△H2=-738.5kJ/mol②
根据盖斯定律:①-②×4可得:P4(s,白磷)=4P(s,红磷)△H=(-2983.2kJ/mol)-(-738.5kJ)×4=-29.2kJ/mol;
热化学方程式为:P4(s,白磷)=4P(s,红磷)△H=-29.2kJ/mol;
故答案为:P4(s,白磷)=4P(s,红磷)△H=-29.2kJ/mol;
(2)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P 198,Cl-Cl 243,P-Cl 331.则反应P4(白磷,s)+6Cl2(g)═4PCl3(s)的反应热△H=198kJ/mol×6+6×243kJ/mol-4×3×331kJ/mol=-1326kJ/mol;
故答案为:-1326kJ/mol.
点评 本题考查了物质结构分析,热化学方程式书写和盖斯定律计算应用,原子守恒和化学方程式的计算方法应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
9.下列叙述中正确的是( )
| A. | 离子晶体中肯定不含共价键 | B. | 离子晶体都易溶于水 | ||
| C. | 分子晶体的熔、沸点一般较低 | D. | 原子晶体键长越大,键能越大 |
10.下列说法正确的是( )
| A. | 反应能否自发进行与温度无关 | |
| B. | 能自发进行的化学反应,一定是△H>0、△S>0 | |
| C. | 放热反应一定都是自发的 | |
| D. | 电解池的反应不属于自发过程 |
4.下列在指定溶液中的各组离子,一定能够大量共存的是( )
| A. | 无色溶液中:CO32-、Al3+、Cl-、NO3- | |
| B. | 无色溶液中:NH4+、K+、CH3COO-、Cl- | |
| C. | pH=1的溶液中:Fe2+、NH4+、Mg2+、NO3- | |
| D. | 水电离的c(H+)=10-12 mol/L的溶液中:Fe3+、SO42-、K+、Na+ |
11.下列过程一定有化学变化发生的是( )
| A. | 淀粉水解 | B. | 酒精挥发 | C. | 水结成冰 | D. | 碘的升华 |
8.化合物HIn在水溶液中因存在以下电离平衡:HIn(红色)?H++In-(黄色) 故可用作酸碱指示剂,浓度为0.02mol•L-1的下列各溶液:①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤Na2CO3溶液 ⑥氨水 ⑦AlCl3溶液,其中能使指示剂显红色的是( )
| A. | ②⑤⑥ | B. | ①④⑤ | C. | ①④⑦ | D. | ①④⑤⑦ |
9.下列实验操作正确的是( )
| A. | 加入盐酸以除去硫酸钠中的少量碳酸钠杂质 | |
| B. | 蒸发时,加热到蒸发皿中出现较多量固体时停止加热 | |
| C. | 用分液漏斗分离液体时,先放出下层液体后,再放出上层液体 | |
| D. | 过滤时,用玻璃棒搅拌漏斗内的混合液以加快过滤速度 |