题目内容
短周期元素W、X、Y、Z的原子序数依次增大,W、X原子的最外电子层电子数之比为4︰3,Z原子比X原子的核外电子数多4。下列说法正确的是
| A.W、Y、Z的电负性大小顺序一定是Z>Y>W |
| B.W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z |
| C.Y、Z形成的分子的空间构型可能是正四面体 |
| D.WY2分子中σ键与π键的数目之比是2︰1 |
C
解析试题分析:由题意可判断,W最外层电子数只能是4,所以W为C元素,X为Al,Z为Cl,Y介于Al、 Cl之间。A、若Y是硅,则电负性W>Y,错误;B、W是第二周期元素,原子半径不可能最大,错误;C、若Y是硅,则Y、Z形成的分子SiCl4,其空间构型是正四面体,正确;D、形成WY2分子,则为CS2,分子中σ键与π键的数目之比是1︰1,错误,答案选C。
考点:考查元素推断,元素周期律的应用,分子的空间构型,分子中共价键的判断

已知R2+离子核外有a个电子,b个中子。表示R原子符号正确的是
A.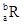 | B.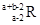 | C.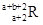 | D.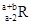 |
X、Y、Z、R、W是5种短周期元素,原子序数依次增大,它们可组成离子化合物Z2Y和共价化合RY3、XW4,已知Y、R同主族,Z、R、W同周期。下列说法不正确的是
| A.原子半径 :Z>R>W |
| B.X2W6分子中各原子均满足8电子结构 |
| C.气态氢化物的稳定性:HmW>HmR |
| D.Y、Z形成的化合物中只可能存在离子键 |
X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是( )
| A.元素非金属性由弱到强的顺序为Z<Y<X |
| B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 |
| C.3种元素的气态氢化物中Z的气态氢化物最稳定 |
| D.原子半径由大到小的顺序为Z<Y<X |
几种短周期元素的原子半径及主要化合价如下表: 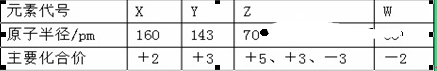
下列叙述正确的是 ( )
| A.X、Y元素的金属性 X<Y |
| B.一定条件下,Z单质与W的常见单质直接生成ZW2 |
| C.Y的最高价氧化物对应的水化物能溶于氨水 |
| D.Z的气态氢化物与其最高价氧化物对应的水化物可以反应 |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是( )
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、M2Z2、W2Z2均为含非极性键的共价化合物 |
| C.由X元素形成的单质有的可以导电 |
| D.由X、Y、Z、M四种元素形成的化合物中不可能含有离子键 |
下列化合物中阴离子半径和阳离子半径之比最大的是 ( )
| A.LiI | B.NaBr | C.KCl | D.CsF |
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是
| A.与W相邻的同主族元素可制成重要的半导体材料 |
| B.元素原子半径从大到小的顺序是X、Y、Z |
| C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构 |
| D.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4 |
依据元素周期表及元素周期律,下列推断中正确的是
| A.同一周期元素的原子,半径越小越容易失去电子 |
| B.ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| C.向氢硫酸溶液中滴入氯水有单质硫生成,可以验证硫元素的非金属性比氯元素弱 |
| D.主族元素的最高正化合价等于该元素原子的核外电子数 |