题目内容
【题目】(1)选择下列实验方法分离物质,将分离方法的序号填在横线上:a、萃取分液法;b、加热分解; c、结晶法; d、分液法; e、蒸馏法; f、过滤法; g、渗析法
①_____从硝酸钾和氯化钠的混合溶液中获得硝酸钾
②______分离水和苯的混合物
③_____除去氢氧化铁胶体中混有的NaCl
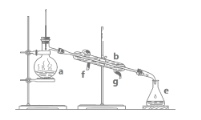
④______分离碘和四氯化碳
(2)实验室用4.0 mol/L NaCl溶液配制100mL 0.50 mol/L NaCl溶液。
①实验需要玻璃棒、胶头滴管、烧杯、量筒外,还需要的玻璃仪器是____________。
②配制上述溶液,需要4.0 mol/L NaCl溶液_________mL。
③配制过程中出现以下情况,使所配溶液浓度偏低_____________。
A.溶液转移后没有洗涤烧杯和玻璃棒。 B.定容时仰视容量瓶的刻度线。
C. 未冷却即进行转移、定容操作。 D.容量瓶中原有少量蒸馏水
E.如果加水超过了刻度线,取出溶液使液面恰好到刻度线。
【答案】c d g e 100ml容量瓶(无100ml不给分) 12.5 A B E
【解析】
(1)①硝酸钾和氯化钠的溶解度随温度的变化不同;
②水和苯互不相溶;
③溶液能透过半透膜,胶体不能透过半透膜;
④碘和四氯化碳沸点不同。
(2)先计算出![]() 溶液的物质的量,再根据溶液稀释过程中溶质的物质的量不变,可计算出需要
溶液的物质的量,再根据溶液稀释过程中溶质的物质的量不变,可计算出需要![]() 溶液的体积。
溶液的体积。
(1)①硝酸钾和氯化钠都溶于水。但硝酸钾的溶解度随温度升高而明显增大,随温度降低而明显减小;而氯化钠的溶解度受温度影响不大。所以从硝酸钾和氯化钠的混合溶液中获得硝酸钾用冷却热饱和溶液结晶法,选c;
②水和苯互不相容,且苯的密度比水的小,所以分离水和苯可用分液法,选d;
③胶体可以透过滤纸,但不能透过半透膜,而溶液既可以透过过滤纸也可以透过半透膜,所以氢氧化铁胶体中混有的![]() 可以渗析法除去,选g;
可以渗析法除去,选g;
④碘易溶在四氯化碳中,但碘的沸点为184℃、四氯化碳的沸点为76.8℃,两者沸点不同,所以可用蒸馏法分离,使四氯化碳蒸出,冷却后烧瓶中剩余的固体或结晶即为碘单质,选e;
(2)①配制一定物质的量浓度的溶液,除了需要玻璃棒、胶头滴管、烧杯、量筒等玻璃仪器外还需要一定规格的容量瓶,配制![]() ,需要用
,需要用![]() 的容量瓶。
的容量瓶。
②![]() 溶液的物质的量为:
溶液的物质的量为:![]() , 需要
, 需要![]() 的体积为:
的体积为:![]()
③A.溶液转移后没有洗涤烧杯和玻璃棒,![]() 减小,浓度偏低,A正确;
减小,浓度偏低,A正确;
B.定容时仰视容量瓶的刻度线,溶液的体积偏高,浓度偏低,B正确;
C. 未冷却即进行转移、定容操作,溶液体积热胀,所加的水偏小,浓度偏大,C错误;
D.容量瓶中原有少量蒸馏水,不影响浓度,D错误;
E.加水超过了刻度线,溶液体积变大,浓度偏小,再取出溶液使液面恰好到刻度线,![]() 减小,浓度偏小,E正确。
减小,浓度偏小,E正确。