题目内容
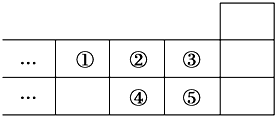 下图是元素周期表的一部分,下列说法中正确的是( )
下图是元素周期表的一部分,下列说法中正确的是( )| A、元素①位于第二周期第ⅣA族 | B、气态氢化物的稳定性:④<② | C、最高价氧化物对应水化物的酸性:⑤>④ | D、元素的最高正化合价:③=⑤ |
分析:A.由元素在周期表中的位置可知,元素①位于第二周期第ⅤA族;
B.同主族自上而下非金属性减弱,非金属性越强氢化物越稳定;
C.同周期自左而右,非金属性增强,非金属性越强最高价氧化物对应水化物的酸性;
D.由元素在周期表中的位置可知,③为F,⑤为Cl,氟元素没有正化合价.
B.同主族自上而下非金属性减弱,非金属性越强氢化物越稳定;
C.同周期自左而右,非金属性增强,非金属性越强最高价氧化物对应水化物的酸性;
D.由元素在周期表中的位置可知,③为F,⑤为Cl,氟元素没有正化合价.
解答:解:A.由元素在周期表中的位置可知,元素①位于第二周期第ⅤA族,故A错误;
B.同主族自上而下非金属性减弱,非金属性越强氢化物越稳定,故气态氢化物的稳定性:④<②,故B正确;
C.同周期自左而右,非金属性增强,非金属性越强最高价氧化物对应水化物的酸性,故酸性:⑤>④,故C正确;
D.由元素在周期表中的位置可知,③为F,⑤为Cl,Cl元素最高正化合价为+7,而氟元素没有正化合价,故D错误,
故选BC.
B.同主族自上而下非金属性减弱,非金属性越强氢化物越稳定,故气态氢化物的稳定性:④<②,故B正确;
C.同周期自左而右,非金属性增强,非金属性越强最高价氧化物对应水化物的酸性,故酸性:⑤>④,故C正确;
D.由元素在周期表中的位置可知,③为F,⑤为Cl,Cl元素最高正化合价为+7,而氟元素没有正化合价,故D错误,
故选BC.
点评:本题考查元素周期表与元素周期律,难度不大,注意掌握元素周期律,注意O、F元素右边没有正化合价及一些元素的特殊性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目







