题目内容
下列关于甲、乙、丙、丁四个图像的说法中,正确的是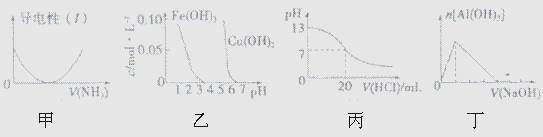
| A.图甲表示向乙酸溶液中通入氨气,此过程中溶液导电性的变化 |
| B.由图乙可知,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右 |
| C.图丙表示25℃时,用0.1 mol/L盐酸滴定20mL 0.1 mol/L氨水,溶液的pH随加入盐酸体积的变化 |
| D.图丁表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化 |
B
解析试题分析:A、乙酸是弱酸,与氨气反应生成强电解质醋酸铵,溶液的导电性增强,A不正确;B、根据图像可知,pH等于4时氢氧化铁已经沉淀完全,而此时铜离子不沉淀,因此若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右,B正确;C、氨水是弱碱,则0.1mol/L的氨水溶液的pH小于13,C不正确;D、根据反应式Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O可知,生成氢氧化铝与溶解氢氧化铝消耗的氢氧化钠是3:1,图像不符合,D不正确,答案选B。
考点:考查电解质电离、溶解平衡、溶液导电性以及氢氧化铝的有关计算

练习册系列答案
相关题目
下列有关物质的性质或应用均正确的是
| A.Si是一种非金属主族元素,其氧化物可用于制作计算机芯片 |
| B.氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂 |
| C.铁具有良好的导电性,氯碱工业中可用铁作阳极电解食盐水 |
| D.用二氧化硫加工银耳,使之更白 |
用下列实验装置能达到实验目的的是( )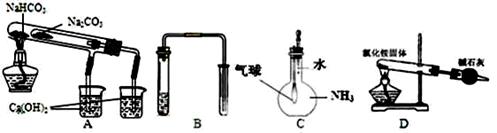
| A.比较NaHCO3和Na2CO3热稳定性大小 | B.用铜和稀硝酸制取并收集少量NO |
| C.验证氨气在水中溶解度的大小 | D.实验室用氯化铵制少量氨气 |
下列说法正确的是
| A.汽油、柴油、植物油都属烃类物质且均为纯净物 |
| B.单质硅常用于制造芯片和光导纤维 |
| C.等质量的气态乙醇和液态乙醇分别完全燃烧,前者放出的热量更多 |
| D.漂白精和明矾都常用于自来水的处理,二者作用原理相同 |
下列说法正确的是( )
| A.铝合金的熔点比纯铝高 |
| B.电解MgCl2溶液可获得金属镁 |
| C.水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
| D.铜具有良好的导电性,常用来制作印刷电路板 |
甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如下图(反应条件及其它产物已略去)。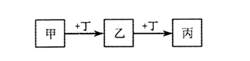
下列说法不正确的是
| A.若甲是AlCl3溶液,则丁可能是NaOH溶液 |
| B.若甲是Fe,则丁可能是Cl2 |
| C.若丁是CO2,则甲可能为Mg |
| D.若丁是O2,则乙、丙的相对分子质量可能相差16 |
下列说法错误的是;
| A.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2 |
| B.硅酸盐NaAlSiO4·nH2O可改写成氧化物形式为:Na2O·Al2O3·2SiO2·2nH2O |
| C.Al65Cu23Fe12是一种拟晶,具有合金的优良物理性能,其硬度比金属Al、Cu、Fe都大 |
| D.过量铁与浓硫酸加热反应可以得到氢气 |
工业上焙烧明矾[ (SO4)2·12H2O]的化学方程式为:4Al(SO4)2·12H2O+3S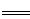 2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
| A.在焙烧明矾的反应中,还原剂与氧化剂的物质的量之比是3:4 |
| B.最后得到的K2SO4溶液呈中性,所以c(K+)=c(SO42-) |
| C.焙烧产生的SO2可用于制硫酸,焙烧948 t明矾(M=" 474" g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸432 t |
D.工业上冶炼Al2O3制得Al,以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是Al+3NiO(OH)+NaOH  NaAlO2+3Ni(OH)2 NaAlO2+3Ni(OH)2 |
下列有关物质的性质与应用不相对应的是
| A.Na2O2能分别与H2O、CO2反应产生氧气,可用作供氧剂 |
| B.硅胶多孔、吸水能力强,常用作袋装食品的干燥剂 |
| C.K2FeO4具有强还原性且被氧化生成Fe3+,可用于水的消毒和净水 |
| D.液氨气化时能吸收大量的热,使周围温度急剧降低,因此可用作制冷剂 |